Плоскость - нитрогруппа
Cтраница 1
Плоскости нитрогрупп в положениях Г, 3 и 5 с плоскостью кольца составляют углы 81, 33 и 13 соответственно. [1]
Углы между плоскостями нитрогрупп и ср. [2]
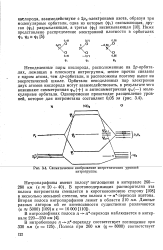 |
Схематическое изображение энергетических уровней нитрогруппы. [3] |
Неподеленные пары кислорода, расположенные на 2р - орбита-лях, лежащих в плоскости нитрогруппы, менее прочно связаны с ядром атома, чем sp - орбитали, и расположены поэтому выше на энергетической шкале. Орбитали неподеленных пар электронов двух атомов кислорода могут взаимодействовать, в результате чего возникают симметричная ф () и антисимметричная ф ( - ) молекулярные орбитали. [4]
С помощью уравнения Мак-Коннела [126] определены [127] главные значения магнитной восприимчивости нитрогруппы: Хъ 11 - Ю-6, Jr 2 - Ю-6 и Jp14 - 10 - 6, где L - направление вдоль связи С-N; Т - направление, перпендикулярное связи С - N; P - направление, перпендикулярное плоскости нитрогруппы. [5]
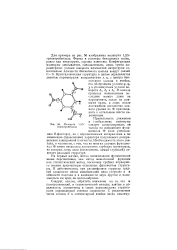 |
Молекула 1 3 5-тринитробензола. [6] |
Форма и размеры бензольных колец, равно как нитрогрупп, хорошо известны. Конфигурация молекулы описывается, следовательно, лишь тремя параметрами: углами поворота плоскостей нитрогрупп относительно плоскости бензольного кольца вокруг связей С-N. Кристаллическая структура в целом определяется девятью параметрами: координатами х, у, z центра бензольного кольца в ячейке, его эйлеровыми углами ф, яр, X и упомянутыми углами поворота бь 62 и бз. В начале процесса минимизации последние можно даже не варьировать, задав их равными нулю, и лишь после достижения достаточно низкого уровня по Ф присоединить к остальным шести переменным. [7]
 |
Молекула 1 3 5-три-нитробензола. [8] |
Для примера на рис. 43 изображена молекула 1 3 5-тринитробензола. Форма и размеры бензольных колец, равно как и нитрогрупп, хорошо известны. Конфигурация молекулы описывается, следовательно, лишь тремя параметрами: углами поворота плоскостей нитрогрупп относительно плоскости бензольного кольца вокруг связей С-N. Кристаллическая структура в целом определяется девятью параметрами: координатами х, у, z центра бензольного кольца в ячейке, его эйлеровыми углами ф, ty, ЗС и упомянутыми углами поворота 6i, 62 и бз - В начале процесса минимизации последние можно даже не варьировать, задав их равными нулю, и лишь после достижения достаточно низкого уровня по Ф присоединить к остальным шести переменным. [9]
 |
Молекула 1 3 5-три-нитробензола. [10] |
Для примера на рис. 43 изображена молекула 1 3 5-тринитробензола. Форма и размеры бензольных колец, равно как и нитрогрупп, хорошо известны. Конфигурация молекулы описывается, следовательно, лишь тремя параметрами: углами поворота плоскостей нитрогрупп относительно плоскости бензольного кольца вокруг связей С-N. В начале процесса минимизации последние можно даже не варьировать, задав их равными нулю, и лишь после достижения достаточно низкого уровня по Ф присоединить к остальным шести переменным. [11]
 |
Молекула 1 3 5-тринитробензола. [12] |
Для примера на рис. 56 изображена молекула 1 3 5-тринитробензола. Форма и размеры бензольных колец, равно как нитрогрупп, хорошо известны. Конфигурация молекулы описывается, следовательно, лишь тремя параметрами: углами поворота плоскостей нитрогрупп относительно плоскости бензольного кольца вокруг связей С-N. В начале процесса минимизации последние можно даже не варьировать, задав их равными нулю, и лишь после достижения достаточно низкого уровня по Ф присоединить к остальным шести переменным. [13]
Атом азота связан с тремя атомами - двумя атомами кислорода и одним атомом заместителя. Связи образуют между собой углы 120, что свидетельствует об 5р2 - гибридизации орбиталей азота. Эти орбитали образуют а-связи. Свободная электронная пара располагается на 2р - орбитали, перпендикулярной плоскости нитрогруппы. Атомы кислорода имеют две sp - гибридизованные орбитали, расположенные вдоль связи N - О, одна из которых участвует в образовании а-связи, а другая занята неподеленной электронной парой. [14]
Так, чтобы указать, что в нитрометане обе связи N-О эквивалентны, нужно использовать две структурные формулы. В этой молекуле связи, присоединенные к атому азота, копланарны. Поэтому, пользуясь терминологией метода валентных связей, можно сказать, что в образовании о-связи участвует 5р2 - гибридная орбиталь атома азота. Как мы видели в начале этой главы, форма молекул в основном определяется их а-связями и поэтому может быть достаточно просто описана с помощью гибридизации. С другой стороны, любая делокализованная я-орбиталь может быть легко описана по методу молекулярных орбиталей. Так, в нитрометане 2рг - орбитали атома азота и двух атомов кислорода расположены перпендикулярно к плоскости нитрогруппы. Поэтому комбинация трех АО приводит к возникновению трех МО. Если в первом приближении мы будем считать, что 2рг - АО азота и кислорода имеют одинаковые энергии, следует ожидать образования одной связывающей, одной несвязывающей и одной разрыхляющей орбиталей. [15]
Страницы: 1