Плотность - ионная атмосфера
Cтраница 1
Плотность ионной атмосферы, ее радиус, скорость возникновения и разрушения сложным образом влияют на термодинамические и электропроводные свойства электролита. [1]
Плотность ионной атмосферы, ее радиус, скорость возникновения и разрушения сложным образом влияют на термодинамические и электропроводные свойства раствора электролита. Влияние этих факторов поддается количественному учету только для простейших электролитов и при условии очень сильного разбавления. [2]
Плотность ионной атмосферы, ее радиус, скорость возникновения и разрушения сложным образом влияют на термодинамические и электропроводные свойства электролита. [3]
Плотность ионной атмосферы увеличивается с ростом концентрации электролита, поэтому оба эффекта торможения увеличиваются с ростом концентрации. [4]
Плотность ионной атмосферы увеличивается с ростом концентрации электролита, поэтому оба эффекта торможения увеличиваются с ростом концентрации. Она количественно связывает экивалентную электропроводность с концентрацией и позволяет вычислить как элект-рофоретический, так и релаксационный эффекты. [5]
Плотность ионной атмосферы различна. Наибольший избыток отрицательных зарядов находится вблизи иона. По мере удаления от центрального иона плотность избыточного заряда становится все меньшей и меньшей, и на некотором расстоянии от иона количество отрицательных и положительных зарядов становится одинаковым; на этом и заканчивается ионная атмосфера. Следовательно, ионная атмосфера имеет некоторые конечные размеры; она характеризуется определенной длиной и плотностью. Чем разбавленнее раствор, тем ионная атмосфера менее плотна и занимает больший объем. [6]
Плотность ионной атмосферы различна. Наибольший избыток отрицательных зарядов находится вблизи иона. По мере удаления от центрального иона плотность избыточного заряда становится вое меньшей и меньшей, и на некотором расстоянии от иона количество отрицательных и положительных зарядов становится одинаковым; на этом и заканчивается ионная атмосфера. Следовательно, ионная атмосфера имеет некоторые конечные размеры; она характеризуется определенной длиной и плотностью. Чем разбавленнее раствор, тем ионная атмосфера имеет меньшую плотность, занимает больший объем и имеет большую длину. Чем концентрированнее раствор, тем плотность ионной атмосферы становится больше, а длина атмосферы соответственно меньше. С повышением температуры плотность ионной атмосферы уменьшается за счет увеличения кинетической энергии ионов. [7]
Плотность ионной атмосферы различна. Наибольший избыток отрицательных зарядов находится вблизи иона. По мере удаления от центрального иона плотность избыточного заряда становится все меньшей и меньшей, и на некотором расстоянии от иона количество отрицательных и положительных зарядов становится одинаковым; на этом и заканчивается ионная атмосфера. Следовательно, ионная атмосфера имеет некоторые конечные размеры; она характеризуется определенной длиной и плотностью. Чем разбавленнее раствор, тем ионная атмосфера менее плотна и занимает больший объем. Чем концентрированнее раствор, тем плотность ионной атмосферы становится больше, а размер атмосферы соответственно меньше. С повышением температуры плотность ионной атмосферы уменьшается за счет увеличения кинетической энергии ионов. [8]
Чем больше плотность ионной атмосферы, тем больше может быть величина заряда положительного полюса и тем с большей силой полярная коллоидная частица может притягиваться к катоду. [9]
Для слабых электролитов плотность ионной атмосферы мала и скорость движения ионов мало зависит от концентрации. [10]
С повышением температуры плотность ионной атмосферы уменьшается за счет увеличения кинетической энергии ионов. [11]
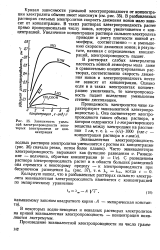 |
Зависимость удельной электропроводности некоторых электролитов от концентрации. [12] |
В растворах слабых электролитов плотность ионной атмосферы мала даже в сравнительно концентрированных растворах, соответственно скорость движения ионов и электропроводность почти не зависят от концентрации. Однако если и в таких электролитах концентрацию увеличивать, то электропроводность падает вследствие уменьшения степени диссоциации. [13]
Дальнейшее повышение Сме раствора приводит к еще большему уменьшению плотности ионной атмосферы и, как результат этого, к резкому возрастанию сил кулоновского взаимодействия из-за быстро уменьшающихся расстояний между ионами железа. [14]
С повышением температуры раствора интенсифицируется тепловое движение ионов, оказывающее влияние на плотность ионной атмосферы. Тепловая интенсификация ионов способ - - ствует увеличению расстояния между ионами и уменьшению сил кулоновского взаимодействия, что подтверждается. [15]
Страницы: 1 2 3