Плотность - газообразное вещество
Cтраница 1
Плотность газообразных веществ и паров определяют по следующим формулам. [1]
Первое измерение распределения плотности газообразного вещества методом комбинационного рассеяния было выполнено Куни [26] в 1968 г. с помощью рубинового лазера на 25 МВт с модуляцией добротности. [2]
Оценим вероятность совершенно пустяковой флуктуации плотности газообразного вещества. Мысленно разделим сосуд с газом на миллиард ячеек. [3]
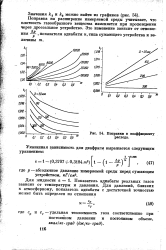 |
Поправки к коэффициенту расхода. [4] |
Поправка на расширение измеряемой среды учитывает, что плотность газообразного вещества изменяется при прохождении через дроссельное устройство. [5]
Только недостаточное знакомство с первоисточниками может привести к такому выводу. Если мы обратимся даже к первой статье Авогадро ( 1811 г.), то убедимся, что он определял молекулярный вес сложных веществ по атомным весам составляющих, а плотность газообразного вещества использовал только для подтверждения результатов по соответствию теоретической плотности с опытной. Этим методам ин пользовался во всех своих работах. Именно в этом химическом подходе при установлении молекулярного веса ( а не физическом) заключается слабая сторона взглядов Авогадро. [6]
В свете идей Дальтона и Берцел иуса молекулярные веса сложных веществ считались производными атомных весов. Даже Авогадро, применяя свою гипотезу, не исходил из молекулярного веса, а наоборот, определял молекулярный вес по атомным весам составляющих, а найденный молекулярный вес проверял по плотности данного газообразного вещества. Выводы Авогадро об атомном составе газообразных соединений опирались или на законы Гей-Люс - сака или, при отсутствии опытных данных, на гипотетические представления. Исходя из признания только одной дискретной частицы - атома, Берцелиус истолковал гипотезу Авогадро по-своему, что привело его к применению плотности для определения атомных весов газообразных элементов. [7]
Молекулярный вес считался производной величиной: его значение вычислялось чисто химическим путем. Даже Авогадро не пользовался методом определения плотности газообразных веществ для непосредственного установления молекулярного веса, а находил его как производную величину, хотя и исходил при этом из предпосылок, которые косвенно были связаны с его гипотезой. [8]
Определение молекулярного веса веществ в газообразном состоянии основано на законе Авогадро. Как известно, в равных объемах газов при одинаковых условиях содержится равное число молекул. Самым легким газом является водород, поэтому удобнее всего определять плотность газообразных веществ по отношению к водороду. [9]
Они бывают: поплавковые - ареометры постоянной массы или постоянного объема; весовые - основаны на непрерывном взвешивании определенного объема жидкости; гидростатические - плотность измеряется по разности давлений двух столбов жидкости разной высоты; радиоизотопные - основаны на измерении ослабления пучка Р - или у-лучей в результате их поглощения или рассеяния слоем жидкости; вибрационные - основаны на зависимости резонансной частоты колебаний, возбуждаемых в жидкости, от плотности жидкости; ультразвуковые - на зависимости скорости звука в среде от ее плотности. Радиоизотопный ультразвуковой, вибрационный и др. методы могут быть применены для определения плотности твердых и газообразных веществ. [10]
Жерар часто исходил из предполагаемой химической формулы вещества, по которой он определял предполагаемый молекулярный вес последнего. Это был по существу химический метод определения молекулярного веса, в котором установление плотности газообразного вещества служило только для контроля. [11]
Иногда плотность газов выражают не по отношению к водороду, а по отношению к воздуху. Водород приблизительно в 14 5 раза легче воздуха. Таким образом, формула М2 D может быть заменена формулой М 2 1) г - 14 5, где D1 обозначает плотность данного газообразного вещества по воздуху. [12]
QPQv - Наоборот, если реакция идет с уменьшением числа киломолей, то Qp: Qv. Наконец, если число киломолей в результате реакции не изменяется, то, очевидно, QP Qv. Полученное соотношение остается верным и в том случае, если в реакции участвуют твердые или жидкие вещества. Так как плотность последних значительно больше плотности газообразных веществ, их объемом можно прнебречь и под А / г следует понимать лишь изменение числа кило-молей газообразных компонентов реакции. [13]
Определение молекулярного веса веществ в газообразном состоянии основано на законе Авогадро. Как известно, в равных объемах газов при одинаковых условиях содержится равное число молекул. Отношение весов молекул двух любых газов равно отношению объемов этих газов и называется плотностью одного газа относительно другого. Самым легким газом является водород, поэтому удобнее всего определять плотность газообразных веществ по отношению к водороду. [14]
Курса органической химии он употреблял эквивалентные веса вместо атомных, а также использовал неправильные атомные веса для большинства металлов) приводила к ряду противоречий. Правильность этой формулы подтверждалась только совпадением плотности пара, определенной экспериментально, с теоретической плотностью. Это был по существу химически метод определения молекулярной массы, в котором уставов -, лепие плотности газообразного вещества служило только для. [15]
Страницы: 1 2