Плотность - ток - коррозия
Cтраница 3
Соответствующие рассмотренным выше состояниям параметры системы принято называть стационарным потенциалом Ес ( потенциал коррозии) и плотностью тока коррозии металла гс. [31]
Поляризационные измерения и обработку полученных данных проводят по известным методикам [209], дополняя их расчетом степени защиты металла от коррозии при магнитной обработке. Расчет заключается в следующем: экстраполяцией тафе-левых участков поляризационных кривых до значений соответствующих потенциалов коррозии определяют величины плотности токов коррозии г ( А / м2), пропорциональные скорости коррозии Ук исследуемого металла, в необработанной О о) и обработанной ( i) водах. [32]
При сварке необходимо так выбирать реким сворки и сварочные материалы, чтобы сварной лов имел брлее положительный электродный потенциал, чем основной металл. В этом случае основной металл будет анодом, но за счет его большой площади контакта с корро-зионно-активной средой плотность тока коррозии будет незначительной, например, для сварки углеродистых и низколегированных сталей рекомендуются электроды с рутьлоыш покрытие. [33]
Для сплавов ниобий-тантал значения тока коррозии в этом растворе также повышаются. Однако они продолжают занимать промежуточное положение между значениями, наблюдаемыми для ниобия и тантала, при этом сохраняется последовательность увеличения плотности тока коррозии по мере уменьшения содержания в сплаве тантала. [34]
Определение скорости коррозии стальных образцов методом экстраполяции тафелефых участков. Метод заключается в получении поляризационных кривых, передающих связь между потенциалом исследуемого электрода и плотностью тока при поляризации от внешнего источника постоянного электрического тока с последующей оценкой эффективности магнитной обработки по плотности тока коррозии в необработанной и обработанной жидкости. Поляризационные кривые получают потенциодинамиче-ским методом. [35]
Авали поляризационных кривых пока вал, что при рН2 ( рис Л, кривая 4) происходит активное растворение металла. Для рН4 ( рисЛ, краше 1 - 3) в анодной ветви наблюдается неустойчивое полевеете пассивной области которое зависит от технологических параметров, а плотности тока в этой области значительно выше плотности тока коррозии. [36]
 |
Схема, поясняющая расчет скорости коррозии по поляризационным кривым. [37] |
Выполнение этого условия необходимо в связи с влиянием сопряженного электродного процесса на величину потенциала. Фактически при снятии катодной поляризационной кривой мы увеличиваем скорость катодного процесса пропорционально плотности внешнего тока, но возмущающее влияние анодного процесса продолжается до тех пор, пока плотность внешнего тока соизмерима с плотностью тока коррозии. [38]
По оси абсцисс отложены плотность внешнего тока ( в логарифмическом масштабе), а по оси ординат - соответствующие величины потенциалов. Теоретически, исходя из кинетических уравнений скорости электродных процессов, между потенциалом и током имеется полулогарифмическая зависимость, поэтому построение в этом масштабе дает возможность путем экстраполяции прямолинейных участков до их взаимного пересечения определить плотность тока коррозии. Очевидно, зная величину стационарного потенцала и зависимость между потенциалом и скоростью одной из электродных реакций ( например, анодной реакции растворения металла), можно также оценить скорость коррозии. В этом случае оценка будет верной, если стационарный потенциал коррозии не изменяется во времени. [39]
 |
Изменение электродного потенциала Nb, Та и. [40] |
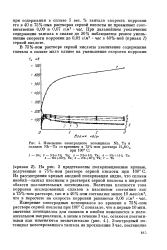
На рис. 3 представлены поляризационные кривые, полученные в 75 % - ном растворе серной кислоты при 100 С. Из рассмотрения кривых анодной поляризации видно, что сплавы ниобий-тантал пассивны в растворах серной кислоты в широкой области положительных потенциалов. Величина плотности тока коррозии исследованных сплавов в пассивном состоянии как в 75 % - ном растворе, так и в 40 % - ном составляет менее 10 мка / см2, что в пересчете на скорость коррозии равняется 0 06 г / м2 час. Измерение электродных потенциалов во времени в 75 % - ном растворе серной кислоты при 100 С показало, что в первые 10 мин. [41]
Это позволяет достаточно точно определить плотность тока коррозии и стационарный потенциал уже в ходе проведения эксперимента. [42]
Все остальные стадии вынуждены иметь скорость, равную скорости лимитирующей стадии процесса. Поскольку коррозионные элементы являются короткозамкнутыми микроэлементами, движение электронов в металле не может быть лимитирующей стадией процесса. Проекция точки пересечения кривых на ось абсцисс дает плотность тока коррозии ( гк), а на ось ординат - потенциал корродирующего металла или сплава. Рассмотрим случай коррозии с лимитирующей катодной реакцией. [43]
Страницы: 1 2 3