Поведение - металл
Cтраница 2
Поведение металлов в процессе анодного растворения исследовано не так полно, как при их катодном осаждении. Все же полученные опытные данные подтверждают применимость основных положений теории электрохимического перенапряжения к металлам железной группы. [16]
Поведение металлов и сплавов в естественных водных средах различно и определяется их составом и структурой, наличием примесей и распределением их в металле, видом поверхностной обработки. В табл. 2 приведены опытные данные по определению коррозионной стойкости железа, ряда сталей и серого чугуна в 5 % - ной соляной кислоте. [17]
Поведение металла на первой стадии - проникновение абразива в поверхность детали - характеризуется явлениями, соответствующими испытаниям на твердость. Вторая стадия изнашивания происходит в процессе взаимного перемещения детали и внедрившегося в ее поверхность абразива. Она включает разрушение поверхностных участков металла и их отрыв. [18]
Поведение металлов в реакциях обусловливается свойством их атомов терять электроны, образуя положительно заряженные ионы. Этим металлы отличаются от неметаллов, атомы которых могут не только терять, но и присоединять электроны, образуя отрицательно заряженные ионы. Самым наглядным примером способности образовывать положительно заряженные ионы служат реакции вытеснения металлов друг другом из их солей в растворе. Эти реакции были всесторонне изучены русским ученым Н. Н. Бекетовым ( 1826 - 1911), на основании чего он составил ряд элементов, названный им вытеснительным рядом. В настоящее время такой ряд называют рядом напряжений. [19]
Поведение металлов при упругой деформации описывается известным законом Гука, который определяет прямую пропорциональность между напряжением и упругой деформацией. [20]
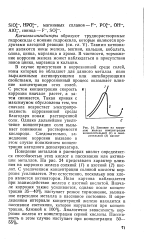 |
Влияние на коррозию железа концентрации неокислительной ( / и окислительной ( 2 кислот. [21] |
Поведение металлов в растворах кислот определяется способностью этих кислот к пассивации или активации металлов. На рис. 24 представлен характер влияния на коррозию железа соляной ( /) и азотной ( 2) кислот. С увеличением концентрации соляной кислоты коррозия усиливается. Это естественно, поскольку ион хлора является активатором. Иная картина наблюдается при взаимодействии железа с азотной кислотой. Вначале коррозия также усиливается, однако после концентрации 35 - 40 % наступает резкое торможение, вызванное переходом металла в пассивное состояние. Аналогична зависимость коррозии железа от концентрации серной кислоты. [22]
Поведение металла при асимметричных циклах можно оценивать с помощью полных диаграмм усталости ( рис. 26), показывающих те сочетания постоянных и переменных напряжений, при которых не происходит разрушение. [23]
Поведение металла при высокой температуре резко отличается от его поведения при нормальной температуре. При высокой температуре действуют с большой интенсивностью такие факторы, которые при нормальной температуре или совершенно отсутствуют, или проявляются с весьма незначительной эффективностью. Наиболее существенными факторами, с которыми приходится считаться при высоких температурах, являются релаксация и ползучесть металлов. [24]
 |
Электродные потенциалы металлов. [25] |
Поведение металлов и сплавов в отношении коррозии может быть объяснено современной теорией электрохимической коррозии. По этой теории металлы и сплавы, всегда химически и физически неоднородные, рассматриваются как состоящие из комплекса анодных и катодных участков, представляющих микроскопические гальванические пары. Коррозию в электролитах можно рассматривать как процесс, протекающий на границе металл - электролит, в результате которого происходит растворение анодных участков металлов и сплавов. [26]
Поведение металла при двухосном растяжении изучено недостаточно полно, в то время как такой вид нагружения наиболее часто встречается в эксплуатации тонколистовых конструкций. [27]
Поведение металлов в процессе анодного растворения исследовано не так полно, как при их катодном осаждении. Все же полученные опытные данные подтверждают применимость основных положений теории электрохимического перенапряжения к металлам группы железа. [28]
Поведение металлов в водороде ( прод. [29]
 |
Температуры плавления, рекристаллизационного отжига и горячей обработки. [30] |
Страницы: 1 2 3 4