Поведение - пара
Cтраница 2
В реальных условиях, когда нефтепродукты содержат свободную воду, металл находится в контакте с двухфазной системой электролит нефтепродукт. Влияние границы раздела фаз на поведение пары электродов, один из которых полностью погружен в электролит, а другой - наполовину, показано на рис. 6.3. Видно, что электрод, частично погруженный в электра-лит, функционирует в качестве эффективного катода. Коррозия развивается на нижней части обоих электродов, но электрод, полностью погруженный в электролит, быстро ( в течение нескольких минут) покрывается продуктами коррозии; на частично погруженном электроде в зоне ватерлинии поверхность остается без изменений. [16]
Указанные анодно-катодные комбинации не являются незыблемыми. Например, при температуре, близкой к точке кипения, поведение пары цинк - железо изменяется на противоположное. [17]
Равномерное возрастание АЯ у гомологов обусловливает более резкие различия между последовательными гомологами при низких абсолютных температурах. И, следовательно, поведение пары / и 2, скорее всего, не должно соответствовать поведению пары 5 и 6 при аналогичных ( низких) температурах. [18]
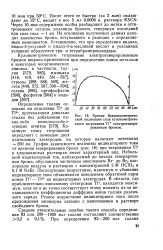 |
Кривая биамперометриче-ской индикации хода кулонометриче-ского титрования Т1 электрогенерированным бромом. [19] |
График зависимости величины индикаторного тока от времени генерирования брома ( рис. 18) при титровании Т1 в хлорнокислых растворах имеет характерный вид. Небольшой индикаторный ток, наблюдаемый до начала генерирования брома, обусловлен частичным окислением Вг - до Вг2 кислородом воздуха в растворах с концентрацией 2 М НС1О4 и 0 1 М NaBr. Последующее возрастание, максимум и убывание индикаторного тока объясняются поведением обратимой пары ионов Т1 - Т13 на индикаторных электродах. В области, где приблизительно наполовину оттитрован Т1, находится максимум, хотя он и не точно соответствует этому моменту из-за неодинаковости коэффициентов диффузии ионов таллия различного заряда. Резкое возрастание индикаторного тока после прохождения минимума связано с накоплением в растворе свободного брома. [20]
 |
Кривая биамперометрической. [21] |
График зависимости величины индикаторного тока от времени генерирования брома ( рис. 14) при титровании иона Т1 в хлорнокислых растворах имеет характерный вид. Небольшой индикаторный ток, наблюдаемый до начала генерирования брома, обусловлен частичным окислением Вг - до Вг2 кислородом воздуха в растворах с концентрацией 2 М НСЮ 4 и ОД М NaBr. Последующее возрастание, максимум и убывание индикаторного тока объясняются поведением обратимой пары ионов Т1 - Т1г на индикаторных электродах. В области, где приблизительно наполовину оттитрован ион Т1, находится максимум, хотя он и не точно соответствует этому моменту из-за неодинаковости коэффициентов диффузии ионов таллия различного заряда. Резкое возрастание индикаторного тока после прохождения минимума связано с накоплением в растворе свободного брома. [22]
Следует специально отметить, что рассматриваемая область не допускает слепого применения каких-либо эмпирических правил, типа мнемонических, поскольку это может привести к ошибочным заключениям. Хотя стереохимические предпосылки для образования циклических производных часто очевидны, однако известно немало примеров, когда невозможно прийти к определенным выводам без детального изучения масштабных пространственных моделей. При этом часто необходимо учитывать механизм применяемой реакции ( хорошим примером может служить изучение резерпина [137]) и, как и во многих других случаях, чрезвычайно полезно сравнивать поведение пары эпимеров. [23]
Следует напомнить, что о термодинамической функции ДО можно говорить только при установлении в системе статистического равновесия. Этому условию отвечают строго исходное и конечное состояния реагирующей системы, а также переходное состояние с учетом ранее сделанных допущений ( см. гл. Теоретический анализ применимости понятий свободная энергия и энтропия ко всем конфигурациям, которым отвечают точки поверхности потенциальной энергии, сейчас отсутствует. Традиционное рассмотрение химических реакций удобно при изучении поведения единичной пары реагирующих частиц А и В и обычно применяется при описании газофазных реакций. Свободная энергия и энтропия в отличие от потенциальной энергии характеризуют лишь статистические ансамбли частиц. С помощью этих функций можно более полно описать поведение реагирующих частиц в растворе, когда каждая из частиц связана с большим числом молекул растворителя. [24]
Большое внимание в литературе уделяется исследованию ХМЭ с комплексами рутения, присоединенными к полимерам или непосредственно к углеродной поверхности. Изучено [174] вольт-амперометрическое поведение комплексов рутения с 1 - ( 9-фенан-трен) - 2 ( 4-пиридин) - этеном, пришитых к поверхности графита. Их редокс-потенциал близок к нормальному потенциалу комплекса в растворе. Однако некоторое расширение максимумов дифференциальной импульсной вольтамперограммы свидетельствует, по мнению авторов, о взаимодействии комплексов на поверхности. В работе [182], где сопоставлено поведение пары Ru ( III) / Ru ( II) в адсорбированном и химически привязанном состояниях, показано, что для обоих способов иммобилизации ре-докс-потенциалы комплексов близки. [25]
Страницы: 1 2