Поведение - спирт
Cтраница 1
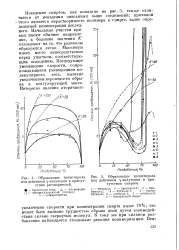 |
Образование полистирола под действием у-излучения в присутствии растворителей.| Образование полистирола под действием у-излучения в присутствии спиртов. [1] |
Поведение спиртов, как показано на рис. 5, также отличается от поведения описанных выше соединений; причиной этого является нерастворимость полимера в спирте, выше определенной концентрации последнего. Начальные участки кривых имеют обычное направление, а большие значения К указывают на то, что радикалы образуются легко. Максимум имеет место непосредственно перед участком, соответствующим осаждению. Последующее уменьшение скорости, сопровождающееся уменьшением молекулярного веса, вызвано увеличением вероятности обрыва в коагулирующей массе. [2]
Поведение спиртов, альдегидов и эфиров в отношении люминесценции, холодных пламен и воспламенения было найдено Преттром вполне подобным поведению парафиновых углеводородов. Отличие состоит только в иных абсолютных значениях температур, при которых происходит возникновение и смена этих явлений. [3]
Различия в поведении разных спиртов и кислот резко проявляются при их растворении в серной кислоте. [4]
Бросается и глаза, что ттоведепш: кислот резко отличается от поведения спиртов и фенола. У кислот / л быстро возрастает до предельного значегшя равного приблизительно двум. В то же щреаш у спиртов и фонола хл непрерывно возрастает, достигая значений, гораздо больших, ч ом два, причем вид кривых в атом случае сильно зависит от природы растворителя и температуры. [5]
Спирты ведут себя во фтористом водороде как сильные бинарные электролиты, что можно объяснить или реакцией спирта с HF с образованием алкил-фторидов и воды, или поведением спиртов как сильных оснований, ведущим к образованию положительных ионов за счет присоединения протона от растворителя и выделению ионов фтора. Если бы первое предположение было правильным, то этиловый спирт, растворенный во фтористом водороде, должен бы обладать такой же электропроводностью, как вода ( при одинаковой молярной концентрации), и при этом должен бы выделяться нерастворимый в HF газ-этилфторид. Следует добавить к этому, что спирт может быть количественно выделен из раствора в HF. Фенол является более кислым спиртом, чем этиловый спирт, и поэтому его раствор во фтористом водороде обладает более слабой электропроводностью. Пикриновая кислота, будучи более кислой, чем фенол, характеризуется еще более слабой растворимостью во фтористом водороде, чем фенол, и обладает еще более слабой электропроводностью. [6]
Перейдя далее к опытам по адсорбции растительных пигментов на различных порошках с большой удельной поверхностью ( которые мы будем называть сорбентами), Цвет обнаружил, что различие в поведении спиртов и лигроина наблюдается и в этом случае: пигменты хорошо адсорбируются из лигроинового раствора, но извлекаются обратно из сорбента при добавлении к лигроину спирта. Поэтому перед адсорбционными опытами необходимо удалять весь спирт из содержащего пигменты экстракта. [7]
По-видимому, более определенный ответ на поставленный вопрос может быть получен, если проследить за путями превращений спирта, образующегося в реальных условиях синтеза, когда основными продуктами синтеза является смесь углеводородов и спиртов. Индикатором поведения спирта мог бы явиться радиоактивный спирт, добавленный к используемому газу в количествах, не нарушающих условий, существующих на поверхности катализатора в период синтеза. Распределение радиоактивности в углеводородах и спиртах должно указать основные пути превращений спиртов в реальных условиях синтеза. [8]
Вызванное адсорбцией понижение поверхностного натяжения для галлия оказывается меньше, чем для ртути. Другим примером может служить поведение гексилового спирта. [9]
Образование олефинов вместо спиртов ( например, бутилен - f - - f - вода, вместо бутилового спирта) рассматривалось Брауном как доказательство того, что спирт не является промежуточным продуктом данной реакции. Исходя из представления о поведении спиртов при повышенных температурах, последняя точка зрения кажется вполне обоснованной. Однако, метильный радикал не единственный, отщепляющийся в виде спирта; из гидратов окисей октил - и цетил-триметиламмония образуется не только октилен, но и октиловый спирт и, соответственно, не один цетилен, но и цетиловый спирт. Аналогичным образом гептиловый спирт сопровождает гептилен при разложении гидрата окиси гептилтриметиламмония. Таким образом, трудность образования углеродных цепей с двойной связью на концах цепи возрастает с удлинением цепи. Является ли такое положение общим правилом, ответить трудно до проведения достаточного количества опытов. [10]
В отличие от радикального присоединения тиолов к алкенам с образованием тиоэфиров соответствующее радикальное присоединение спиртов к алкенам не дает удобного пути для получения простых эфиров. Причины такого различия в поведении спиртов и тиолов определяются различиями в энергии связей; связь Н - О прочнее связи Н - С, которая, в свою очередь, прочнее связи Н - S. В соответствии с этим в свободно-радикальных реакциях с тиолами преимущественно происходит отщепление атома водорода от связи Н - S, тогда как в случае спиртов имеет место преимущественное отщепление атома водорода от связи Н - С, а не Н - О, и, кроме того, предпочтительно происходит полимеризация, а не перенос цепи. [11]
Сопоставляя давление паров воды и этилового спирта, можно заключить, что при любой температуре давление паров спирта выше давления паров воды, причем в условиях низких температур это различие больше, чем при высоких температурах. Это определяет поведение спирта в процессе перегонки. [12]
Близок к этим исследованиям большой цикл работ Т. А. Фаворской и сотрудников, начатый еще совместно с А. Е. Фаворским [196, 197], В этих работах изучалось действие минеральных и органических кислот различной концентрации и некоторых других кислых агентов на третичные спирты ряда циклобутана [197] и циклопропана [198, 199] с различными алкилъными и арильными радикалами в боковой цепи. В этих исследованиях на большом количестве примеров было изучено влияние условий реакции и природы заместителей на устойчивость цикла. Особенно подробно исследовано поведение спиртов циклопропаново-го ряда, стремящихся под действием кислых агентов перейти в производные с открытой цепью углеродных атомов. [13]
В дибутиловом эфире в результате взаимодействия растворителя со спиртом отсутствует мономерный спирт. Добавление основания не влияет на поведение присутствующего спирта и приводит лишь к их незначительному взаимодействию с образованием малоустойчивого комплекса основание-спирт. Таким образом, в дибутиловом эфире основание взаимодействует главным образом с изоцианатом. Слабый комплекс основание-спирт также может действовать на изоцианат, в результате чего возникнет комплекс основание-изоцианат. Концентрация последнего комплекса пропорциональна концентрации основания, чем и обусловлено линейное соотношение между скоростью и концентрацией основания. С другой стороны, в толуоле взаимодействие основания со спиртом становится заметным и устойчивость этого комплекса значительно выше, чем в дибутиловом эфире. Количество присутствующего в толуоле спирта в молекулярной форме является функцией концентрации основания. [14]
Многочисленные опубликованные в литературе сообщения указывают на то, что подобные явления характерны и для других соединений, содержащих алифатические цепи углерода. Температуры незначительно меняются при изменении отношения топлива к воздуху, если топливо берется в избытке; они заметно снижаются для высших к-пара-финов; повышаются при замене парафина соответствующим олефшюм или нафтеном или при замене ненасыщенного циклического соединения типа циклогексена насыщенным типа циклогексана. При этом ароматические соединения намного устойчивее к окислению, чем парафиновые или нафтеновые соединения. Способность углеводородов к окислению тесно связана с детонационной характеристикой топлив, установленной при моторных испытаниях. Поведение спиртов, альдегидов и эфиров подобно поведению парафинов, но отличается температурными порогами; особенно низкие температуры характерны для этилового эфира. [15]
Страницы: 1