Амфотерное поведение
Cтраница 1
Амфотерное поведение Al, Ga и In также используют для их выделения из разнообразных смесей. [1]
Гидрохинон своим амфотерным поведением похож на воду и хлористый водород. Он может вести себя как кислота по отношению к основаниям или как окислитель по отношению к восстановителям благодаря наличию подвижных протонов. Или же он может реагировать в качестве основания по отношению к кислотам и в качестве восстановителя по отношению к окислителям ( в частности, в воде) благодаря иону гидрохинона. [2]
Различными авторами [3, 4] показано, что амфотерное поведение кремния и германия в GaAs зависит от числа вакансий на местах Ga и As и его можно контролировать изменением давления паров мышьяка в процессе выращивания кристаллов. [3]
Незамещенные и монозамещенные гидроксамовые кислоты напоминают амиды амфотерным поведением. Протонирование также подчиняется функции кислотности На ( измеренной с помощью амидных индикаторов) и, следовательно, происходит по карбонильному кислороду ( 130) ( как и в случае амидов, см. разд. Это может быть связано, по крайней мере частично, с индукционным оттягиванием электронов от соседнего электроотрицательного гетероатома ( О или N); вместе с тем сопряженные основания как из RCONROH, так и из RCONHOH, могут затем стабилизоваться за счет внутримолекулярных водородных связей. [4]
Образуется [ ( C2H5) 2NH2 ] 2Zn ( NO3) 4 NO, аналогично амфотерному поведению Zn в воде. [5]
В двух предыдущих разделах доказано, что многие вещества могут реагировать и как кислоты и как основания в зависимости от того, с какими веществами они реагируют. Амфотерное поведение, невидимому, гораздо более распространено, чем это предполагалось раньше. [6]
Гидрид сурьмы ( Ш) ( стибин, сурьмянистый водород) SbH3 по свойствам и токсичности аналогичен арсину АзНз. С; проявляет амфотерное поведение. [7]
В большинстве случаев примесные атомы элементов IV группы преимущественно локализуются в одной из подрешеток. Однако в некоторых соединениях AlllBv наблюдается их амфотерное поведение. Установлено, например, что в фосфиде галлия при уровнях легирования ниже 1018 см 3 германий ведет себя как акцептор, а при более высоких концентрациях начинает сказываться его донор-ное действие. Поскольку выпадение вторичной фазы германия не обнаружено вплоть до концентрации WGe ж 1020 см-3, то есть все основания предполагать одновременное замещение германием разноименных атомов решетки с образованием нейтральных пар. Иное поведение характерно для кремния в GaP. В дальнейшем избыточная концентрация доноров составляет лишь небольшую долю общего содержания кремния. [8]
Гидроксиды и оксиды простых катионов, которые растворимы в кислотах ( с образованием гидратированных катионов), а также в основаниях ( с образованием растворимых анионов), называются амфогперными ( см. разд. Для мягких катионов величина ионного потенциала не является достаточным критерием амфотерного поведения; гораздо более важную роль в этом отношении играют особенности электронного строения иона. Так, Sn2 с ионным потенциалом 1 82 образует вполне амфотерный гидроксид, в то время как Fe3 с ионным потенциалом 4 70 не дает гидроксидов с амфотерными свойствами. [9]
Электроотрицательность элементов в этой группе различна; она довольно высока для Be ( l 1 47), что обусловливает его амфотерное поведение, и типично металлическая у остальных элементов. [10]
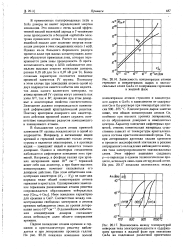 |
Зависимость концентрации атомов. [11] |
В большинстве случаев атомы примесей элементов IV группы локализуются в одной из подрешеток. Например, в антимониде индия кремний и германий замещают только атомы сурьмы и являются акцепторами, а в арсениде индия - замещают индий и являются только донорами. Однако в некоторых соединениях наблюдается амфотерное поведение этих примесей. Например, в фосфиде галлия при уровнях легирования ниже 1018 см-3 германий ведет себя как акцептор, а при более высоких концентрациях начинает сказываться его донорное действие. [12]
Не исключается другая форма для этих веществ, предполагающая их существование в виде молекулярных комплексов SF4O - МРЖ. Поэтому необходимы дальнейшие экспериментальные доказательства, подтверждающие амфотерное поведение тионилтетрафторида. [13]
Дальнейшими многочисленными примерами могут являться все без исключения многоосновные кислоты и многокислотные основания, такие, как Н3РО4, Н2РО4, НРО. РОГ или [ А1 ( ОН) 4 ] -, А1 ( ОН) 3, А1 ( ОН), АЮН2, Al ( H2O) f, отдельные ступени диссоциации которых все связаны кислотно-основными равновесиями. Совершенно аналогичные ряды наблюдаются также в амминосистеме; во фторосистеме амфотерное поведение встречается очень часто. [14]
Страницы: 1