Электрохимическое поведение - железо
Cтраница 1
Электрохимическое поведение железа, находящегося в зазоре, в растворах ортофосфата аналогично поведению железа в растворах нитрита натрия и чугуна в растворах бихромата калия. Потенциалы железа в узких зазорах с течением времени становятся более отрицательными и приобретают значения, равные - 0 5 В. [2]
Исследования электрохимического поведения фосфа-тированного железа и оксидированного алюминия показывают, что по мере образования фосфатной и оксидной пленки происходит постепенное изменение потенциала металла, что не может быть следствием чисто механического экранирования. [3]
Таким образом, электрохимическое поведение железа или стали в присутствии ингибиторов коррозии коллоидного типа носит в двухфазных средах своеобразный характер и обусловлено в основном структурой и особыми свойствами экранирующей пленки ингибитора, возникающей на поверхности металла в процессе защиты. [4]
Поэтому результаты исследований электрохимического поведения железа и никеля в растворах щелочи при различных плотностях тока, температуре и концентрации электролита представляют не только научный, но и большой практический интерес. Они позволили вначале в общем правильно выбрать материалы для электродов и для изготовления других деталей и аппаратов электролизных установок, а позднее помогли выяснить и в большинстве случаев устранить причины коррозии деталей фильтрпрессных электролизеров. [5]
Различие в сохранности НЖ и НК аккумуляторов объясняется различием электрохимического поведения железа и кадмия в растворах щелочей. Если железо в щелочном электролите термодинамически неустойчиво и этим явлением объясняется высокий саморазряд железного электрода, то равновесный потенциал кадмия в тех же условиях положительное равновесного потенциала водородного электрода, и самопроизвольное растворение чистого кадмия в растворах щелочи невозможно. Поэтому НК аккумулятор обладает низким саморазрядом. [6]
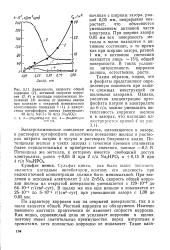
Диаграмма возможных электронных реакций железа позволяет сде-дать некоторые предположения об электрохимическом поведении железа, обосновать условия стойкости металлической фазы. [7]
Исследования процесса электровосстановления железа из неводных растворов достаточно многочисленны [ 681, 684, 1136, 1153, 714, 1012, 722, 1005, 742, 780, 1233, 1134, 989, 718, 470, 997, 737, 879, 62, 63, 504, 1089, 897, 1173, 1260, 914 ], однако большинство из них относится к комплексообразующим электролитам, и лишь в некоторых работах уделено специальное внимание электрохимическому поведению железа. По полярографическим данным в перхлоратных растворах восстановление ионов Fe3 и Fe происходит необратимо: первого - в две ступени, второго - одноступен-чато. [8]
Последующий нагрев способствует удалению значительной части поглощенного водорода. Электрохимическое поведение железа и никеля, полученных электролизом водных растворов, отличается от поведения тех же металлов после переплавки, во время которой водород удаляется. [9]
На основе общих соображений избирательное растворение сплава должно сопровождаться обогащением его поверхности более благородным компонентом и иметь место при условиях, при которых скорости растворения составляющих сплав компонентов в индивидуальном состоянии заметно различаются друг от друга. Соответствующий анализ электрохимического поведения железа и хрома в активном состоянии позволяет предположить, что их сплавы в активной области потенциалов должны растворяться с преимущественным переходом в раствор хрома. [10]
В основу книги положены данные, полученные в лаборатории гальванических покрытий Института прикладной физики АН MGCP и Отраслевой лаборатории при кафедре Ремонт машин КСХИ им. В ней описываются электрохимическое поведение железа, свойства электролитов железнения, структура и свойства железных покрытий, приемы предварительной подготовки поверхностей под нанесение покрытий, способы железнения, пути интенсификации и совершенствования электроосаждения железа и его сплавов. [11]
Поскольку в работах подтверждено, что реакции разряда-ионизации идут через стадию адсорбции промежуточных реакций на поверх - ности, то важно изучить влияние состояния поверхности и хемосорбции на механизм процесса, его кинетические параметры. Как было показано, причиной разных механизмов растворения железа и кинетических параметров электродных реакций является различное состояние поверхности электрода, которое влияет на электрохимическое поведение железа и специфику химических реакций на межфазных границах. [12]
Поглощение водорода создает значительные искажения кристаллической решетки и резко ухудшает механические свойства металла. Последующий нагрев способствует удалению значительной части поглощенного водорода. Электрохимическое поведение железа и никеля, полученных электролизом водных растворов, отличается от поведения тех же металлов после переплавки, во время которой водород удаляется. [13]
В первую очередь это относится к основному компоненту стали - железу. Литературные данные об электрохимическом поведении железа в растворах перекиси водорода ограничиваются работой Бианки [1], в которой установлено, что при катодной поляризации железного электрода в разбавленных нейтральных растворах перекиси водорода восстановление кислорода и перекиси водорода происходит так же, как и на электроде из нержавеющей стали. [14]
При катодном восстановлении металлов, способных растворять атомарный водород, происходит их наводороживание, Ю. В. Баймаков и М. И. Замоторин, исследуя железо, полученное при помощи электролиза, обнаружили в нем до 9 2 ат. Поглощение водорода создает значительные искажения кристаллической решетки и резко ухудшает механические свойства металла. Последующий нагрев способствует удалению значительной части поглощенного водорода. Электрохимическое поведение железа и никеля, полученных электролизом водных растворов, отличается от поведения тех же металлов после переплавки, во время которой водород удаляется. [15]
Страницы: 1 2