Электрохимическое поведение - титан
Cтраница 1
Электрохимическое поведение титана при контакте в морской воде с другими металлами аналогично поведению нержавеющей стали. Сан титан во многих случаях ускоряет процесс корродирования контактирующих с ним металлов. [1]
Исследовано электрохимическое поведение титана в растворах серной кислоты, содержащих ионы четырехвалентного титана в зависимости от концентрации серной кислоты, концентрации ионов четырехвалентного титана и температуры растворов. [2]
Исследовано электрохимическое поведение титана BTI-0 и сплавов титана 4200 и 4207 в растворах KBr и ывг посредством снятия анодных потенциодинамических кривых и хроноамперометричес - них кривых. [3]
 |
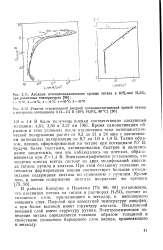
Анодные поляризационные кривые для титана ( 1 и гидрида тн-тана ( 2 в 2 н. H2SO4. [4] |
Большинство авторов, изучавших электрохимическое поведение титана, связывает пассивность с образованием на поверхности металла защитного окисного слоя. Известны попытки изучить соетав окисной пленки на анодно запассивированном титане. [5]
В работе [32] показано соответствие электрохимического поведения титана и гидрида Т1Н2 в растворе H2SO4, в частности потенциалы их пассивации практически полностью совпадают. [6]
В связи с тем, что в процессе электролиза сточной воды рН может меняться весьма значительно, было изучено электрохимическое поведение титана, как наиболее стойкого материала, при: различных рН и температуре 90 С. [7]
Защитная пассивная пленка на титане в растворах - H2S04 состоит из сплошного барьерного слоя, прилегающего к металлу, и внешнего менее сплошного слоя. Электрохимическое поведение пассивного титана определяется в основном толщиной и свойствами барьерного слоя. Если барьерный слой формируется пря более положительных потенциалах ( в интервале от 0 14 до 1 4 В) [105], его защитные свойства улучшаются. [8]
Повышение коррозионной стойкости титана катодным легированием является перспективным направлением, так как этим способом удается небольшими добавками легирующего элемента значительно повысить коррозионную устойчивость титана. Третий легирующий компонент должен либо смещать потенциал полной пассивации титана в отрицательную сторону, либо значительно снижать ток анодного растворения титана вблизи потенциала полной пассивации, либо влиять на электрохимическое поведение титана по этим двум направлениям одновременно. Для достижения высокой коррозионной стойкости титана путем легирования термодинамически более стойким металлом или металлом, более легко пассивирующимся, необходимо введение значительного количества лег и р ующего компонента. [9]
В работах Коицуми и Накаяма [73; 98; 99] установлено, что пассивная пленка на титане в растворах H2SC4 состоит из сплошного слоя, прилегающего к металлу, и несплошного внешнего слоя. Подслой при комнатной температуре аморфен, а при более высокой имеет структуру анатаза. Несплошной внешний слой имеет структуру рутила. Электрохимическое поведение титана определяется главным образом толщиной и свойствами сплошного барьерного слоя оксида, прилегающего к металлу. [11]
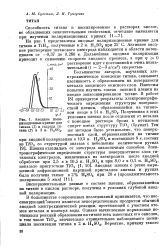
В работах Коицуми и Накаяма [46, 67, 68] было установлено, что пассивная пленка на титане в растворах Н2 О4 состоит из сплошного слоя, прилегающего к металлу, и несплошного внешнего слоя. Подслой при низких температурах аморфен, а при повышенных имеет структуру анатаза. Несплошной внешний слой имеет структуру рутила. Электрохимическое поведение пассивного титана определяется главным образом толщиной и свойствами сплошного барьерного слоя окисла, прилегающего к металлу. [12]
Рассмотрены Теоретические основы метода измерения поляризационных характеристик металлов в электролитических средах с высоким омическим сопротивлением, а также метода разделения омической в поляризационной составляющих потенциала на изолированном электроде при поляризации пульсирующим током. Даются основные принципы построения приборов и установок для подобного рода исследований. Приводятся результаты изучения переноса реагирующих частиц через диффузионный слой на границе металл - электролит с использованием метода поляризации прямоугольным током низкой частоты. На примере исследования электрохимического поведения титана в растворах серной кислоты показано, что применение метода поляризации несимметричным переменным током обеспечивает получение дополнительной информации о кинетике образования пассивирующих слоев на поверхности металла. [13]
Анализ приведенных данных показывает, что процессы окис-лообразования и пассивации титана не могут быть простыми. В частности, приходится отбросить предположение о возможности образования пассивирующего окисла в результате обычных реакций с участием атомов титана и молекул воды, так как отвечающие им нормальные потенциалы для всех известных окислов титана значительно отрицательнее наблюдаемого потенциала пассивации титана. Причина такого явления лежит в том, что поверхность титана всегда покрыта гидридным слоем, и в реакциях с водой участвует не сам титан, а его гидрид. В работе [26] показано соответствие электрохимического поведения титана и гидрида TiH2 в растворе H2SO4, в частности практически совпадают потенциалы их пассивации. [14]
Страницы: 1