Поверхность - ликвидус - система
Cтраница 1
Поверхность ликвидуса системы КС1 - ТаС15 - UCU состоит из полей UCU, КС1, ТаС15, K2UCle, KUzClg, KTaCle. К боковой стороне КС1 - ТаС15 примыкает область расслаивания. [1]
Поверхность ликвидуса системы состоит из полей МоОС14 тв. [2]
Поверхности ликвидуса систем состоят из полей NaCl, KMgCl3, KTa ( Nb) Cle ( поля невелики по размерам) и тв. Для большинства смесей, составы которых находятся в полях KMgCl3, NaCl и тв. NaCl - KMgCl3, наблюдается расслаивание в жидком состоянии. Расслаивание в системах KTa ( Nb) Cle - KMgCl3 - KC1, подобных системам KTa ( Nb) Cle - KMgCl3 - NaCl, невелико. [3]
Поверхность ликвидуса системы разделяется на 12 полей кристаллизации в соответствии с характером выделяющихся первичных фаз и имеет следующую особенность: тройные соединения обладают низкой температурой плавления ( не выше 725) и сильно диссоциируют в расплаве. В связи с этим и температуры поверхности ликвидуса также низки ( лежат в пределах 570 - 750) для всей центральной части системы. Более высокие температуры ликвидуса встречаются только в пределах полей SiO2, Na2SiO3, Na2Si2Os в участках, прилегающих к этим соединениям. [4]
Представлена поверхность ликвидуса системы. Тройная кратная точка лежит, по-видимому, вблизи вершины SnCL. При совместном присутствии хлоридов растворимость их в ЗпСЦ заметно повышается. [5]
В работе выполнено повторное исследование поверхности ликвидуса системы NaCl - КС1 - СгС13, показавшее возможность приложения положений термодинамической теории азеотрошшх систем в целях критического анализа данных для систем эвтектических. Существующие для исследованной системы данные дополнены и исправлены. [6]
 |
Изотермическое сечение диаграммы состояния ( 451 между самой нижней двойной эвтектической точкой es и самой верхней тройной эвтектической точкой Е. [7] |
Это хорошо видно на рис. 452, представляющем поверхности ликвидуса системы в виде проекций изотерм на концентрационный треугольник. Максимальная точка на поверхности ликвидуса совпадает с максимальной точкой на поверхности S4sis552s6sss4 солидуса. Эта их общая точка является точкой плавления соединения. [8]
В подобных случаях, когда разность тепловых эффектов мала, что указывает на неярко выраженный характер стабильности, требуется экспериментальное подтверждение. Изучение поверхности ликвидуса системы AgBr - KNO3 - NaGl [ 861 подтверждает базис-ность данного треугольника. [9]
В подобных случаях, когда разность тепловых эффектов мала, что указывает на неярко выраженный характер стабильности, требуется экспериментальное подтверждение. Изучение поверхности ликвидуса системы AgBr - KNO3 - NaCl [ 861 подтверждает базис-ность данного треугольника. [10]
 |
Таблиц. 1. Библиографий 9.| Библиографий 6. УДК. [11] |
В системе обнаружены твердые растворы на основе арсенида индия, а также допускается возможность существования фаз InAsTe, InAsTes, плавящихся с разложением при температурах 680 и 390 С соответственно. По результатам исследования построена схема поверхности ликвидуса системы индий-мышьяк-теллур. Предполагается возможность проявления амфотерных свойств теллура. [12]
Квадрат состава является основанием призмы, представляющей политермическую диаграмму плавкости тройной взаимной системы солей. На перпендикулярах, восстановленных из точек квадрата, откладывают температуры плавления, множество которых является поверхностью ликвидуса системы. ТакаяЦпространственная диаграмма для системы К2С1а - MgSO4 показана на рис. 5.47. Она аналогична политермической диаграмме. [13]
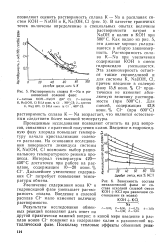 |
Зависимость состава металлической фазы от состава исходной солевой смеси. [14] |
Проведенные исследования позволяют ответить на ряд вопросов, связанных с практикой получения калия. Введение в гидроксид-ную фазу хлорида повышает температуру начала кристаллизации солевого расплава. На основании исследования поверхности ликвидуса системы К, Na OH, C1 возможен выбор рационального температурного режима процесса. Интервал температуры 420 - 450 С достаточен при работе на расплаве, содержащем 10 - 20 ионн. Дальнейшее увеличение содержания С1 - потребует повышения температуры обмена. [15]
Страницы: 1 2