Повышение - концентрация - катион
Cтраница 1
Повышение концентрации катионов у поверхности металла сопровождается ростом запаса энергии их. Действительно, если бы катионы не притягивались отрицательно заряженнцй поверхностью металла, то они отошли бы друг от друга на возможно большие расстояния. [1]
Повышение концентрации катионов у поверхности металла сопровождается ростом запаса энергии их. Действительно, если бы катионы не притягивались отрицательно заряженной поверхностью металла, то они отошли бы друг от друга на возможно большие расстояния. [2]
 |
Схематическое изображение сольватации и растворения катионов металла. [3] |
Повышение концентрации катионов у поверхности металла сопровождается ростом запаса энергии их. [4]
Так как повышение концентрации катионов уменьшает потенциал разряда катиона, то, естественно, из более концентрированных солей осаждение производится при меньшем потенциале, чем из более разбавленных растворов. Так, например, при электролизе 2 % - ного раствора AgNO3 в присутствии Cu ( NO3b медь, обладающая менее электроположительным потенциалом, на катоде не выделяется, если она содержится в небольшом количестве. Однако если концентрация меди достигнет 5 %, то начинается ее совместное выделение с серебром. [5]
Этот эффект увеличивается с повышением концентрации катиона, а при одинаковой концентрации - с ростом валентности и адсорбируемости катиона. Фрумкин [112] разделяет восстанавливающиеся анионы на две группы по действию на их волны прибавляемого электролита. [6]
Ресорбция загрязнений повышается с повышением концентрации катиона, находящегося в растворе, и его валентности. При стирке кар-боксиметилцеллюлоза должна возможно скорее, прийти в соприкосновение с загрязненным бельем, по возможности даже раньше, чем моющее средство удалит загрязнение с ткани. [7]
Этот эффект увеличивается с повышением концентрации катиона, а при одинаковой концентрации - с ростом валентности и адсорбируемости катиона. Фрумкин [112] разделяет восстанавливающиеся анионы на две группы по действию на их волны прибавляемого электролита. [8]
 |
Схема процесса поверхностного растворения металла в воде.| Двойной электрический слой на границе цинк-вода. [9] |
В этом случае состояние равновесия поверхностного растворения металла сместится: повышение концентрации катионов цинка в растворе усиливает процесс осаждения ионов из раствора на металл. В результате равновесие устанавливается при меньшей разности потенциалов на границе металл-раствор. [10]
 |
Различные зависимости логарифма плотности тока от потенциала при анодном растворении металлов. [11] |
Процесс растворения металла при высоких плотностях тока осложняется диффузионными затруднениями, при этом происходит повышение концентрации катионов у поверхности электрода. Иногда это повышение столь значительно, что может превысить произведение растворимости соли, которая тогда выпадает на поверхности электрода, образуя непроводящую ток пленку, и скорость процесса снижается. Это явление называется солевым пассивированием электрода. При значительной доле концентрационной поляризации в уравнения кинетики растворения должны быть внесены соответствующие поправки на изменение концентрации катионов у поверхности электрода. Из принципа микрообратимости электродного процесса следует, что вблизи равновесного потенциала как в катодном, так и в анодном процессах замедленной должна быть одна и та же стадия. [12]
При добавлении в ванну солей натрия или калия количество осажденного на ткани угля по мере повышения концентрации катиона одновалентного металла увеличивается. Кальциевые и магниевые соли действуют сильнее, чем соли натрия и калия, и еще более эффективно влияют добавки алюминиевых солей. Осаждение угля на ткани аналогично коагуляции золя, и, по-видимому, к этой системе применимо правило Шульца-Харди, согласно которому коагулирующая способность катиона увеличивается с повышением его валентности. В развитие этой аналогии необходимо отметить, что сама суспензия угля подобна типичному золю независимо от присутствия в ней ткани. Натриевые соли вызывают флоккуляцию суспензии, кальциевые и магниевые соли действуют еще более эффективно. [13]
Во вторую группу входят катионы Si, В, Р, А1 и другие, у которых величина энергии ковалентной связи с анионами кислорода заметно больше, чем в первой группе. Повышение концентрации катионов второй группы приводит к существенным отклонениям от теории совершенных растворов. [14]
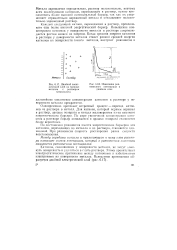 |
Двойной электрический слой на границе металла с раствором электролита.| Изменение равновесного потенциала в двойном слое. [15] |
Страницы: 1 2