Повышение - сила - кислота
Cтраница 1
Повышение силы кислоты и валентности иона способствует замещению гидроксильного иона другими анионами. [1]
Для водных растворов утверждение о повышении силы кислот от уксусной к трихлоруксусной сколь верно столь и незыблемо. Например, в диметиланилине - сильноосновном растворителе, который для краткости обозначим символом S. Из сказанного ранее вытекает, что процесс взаимодействия кислоты ( НА) с пиридином запишется в виде схемы HA-S - f - Py HA-Py - f - S. Как видим, изучаемая реакция сводится к конкурентной борьбе за кислоту между пиридином и растворителем. Чем сильнее кислота, тем она сильнее держится за основный растворитель, за молекулу S. [2]
Из этих данных следует, что с повышением силы кислот и оснований увеличивается полярность образованного соединения. [3]
Интересен в этом отношении рис. 16, на котором показана зависимость константы скорости щелочного гидролиза производных кислот фосфора от силы соответствующей кислоты, остаток которой входит в молекулу фосфорсодержащего соединения в виде галоидной или псевдогалоидной группы. Из графика видна общая тенденция к увеличению скорости щелочного гидролиза с повышением силы кислоты НХ, где X - галоид или псевдогалоидная группа в производных кислот фосфора. [4]
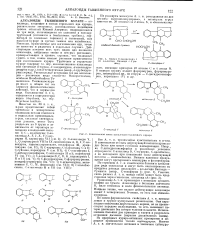 |
Синтез С-токофершкч 1.| Генетическая связь алкалоидон тинненноги кураре. [5] |
В зависимости от силы действующей кислоты происходит более или менее глубокая изомеризация. С-дигидротоксиферина в различных условиях образуются: С-алкалоид D, С-курарип, С-калебассин, а из последнего при повышении силы действующей кислоты - изокалебассин. Важное взаимное превращение могут претерпевать мавакурии и флуорокурин. [6]
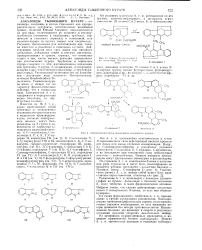 |
Синтез С-токпферин I.| Генетическая свпаь алкалоидов тыквенного кураре. [7] |
В зависимости от силы действующей кислоты происходит более или менее глубокая изомеризация. С-дигидротокс иферина в различных условиях образуются: С-алкалоид I), С-курарин, С-калебассии, а из последнего при повышения силы действующей кислоты - изокалебассин. Важное взаимное превращение могут претерпевать мавакурип и флуорокурин. [8]
Большинство современных анионитов представляет собой слабые органические основания. Они хорошо извлекают из растворов анионы сильных кислот и очень слабо или совсем не извлекают анионов слабодиссоциирующих кислых продуктов, например фенола, синильной, кремниевой, борной и других кислот. Повышение силы кислоты и валентности иона способствует замещению гидроксильного иона другими анионами. [9]
В целом кислотность обнаруживает тенденцию к возрастанию с увеличением формального заряда на центральном атоме. Чем больше формальный положительный заряд на центральном атоме, тем больше такой центральный атом оттягивает к себе электроны от связанных с ним атомов кислорода. Это приводит к ослаблению связи кислород-водород и способствует более легкому отрыву протона Н, а следовательно, означает повышение силы кислоты. Влияние формального заряда центрального атома на кислотность родственных соединений иллюстрируется данными табл. 11 - 1; даже небольшое возрастание отрицательного заряда на атоме, к которому присоединен протон, очень сильно понижает кислотность соединения. [10]
Страницы: 1