Повышение - скорость - реакция
Cтраница 1
Повышение скорости реакции под влиянием соседней группы, известное под названием анхимерное ускорение, проявляется главным образом тогда, когда возможно промежуточное замыкание 5 - п 6-членных циклов. Такой эффект имеет место и в низкомолекулярных бифункциональных соединениях, например сложных эфнрах янтарной кислоты. Известны также отрицательные эффекты соседней группы. Пониженные скорости реакции и менее чем 100 % - ная степень превращения наблюдаются в некоторых случаях вследствие электростатического отталкивания между химическим агентом п реагирующей функциональной группой, когда оба они имеют одинаковый заряд. [1]
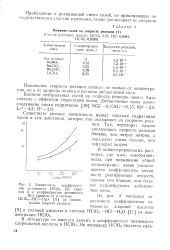 |
Влияние солей на скорость реакции ( 1.| Зависимость коэффициентов активности НС1О4 ( кривая / и коэффициентов активности. [2] |
Повышение скорости реакции зависит не только от концентрации, но и от природы аниона и катиона добавляемой соли. [3]
Повышение скорости реакции с увеличением поверхности пузырьков кислорода, пропускаемого через раствор N2O4 - H2O, связано с большей скоростью окисления или разложения азотистой кислоты под действием интенсивного перемешивания и с возможным окислением окиси азота в жидкой фазе. На возможность протекания процесса гетерогенного окисления растворенной окиси азота указывают данные о растворимости NO в азотной кислоте. [5]
Повышение скорости реакции, по-видимому, связано с увеличением электрофильности атома фосфора за счет переноса протона свободной оксигруппы двух -, трех-функционального фенола на фосфонильный кислород GB или образования водородной связи между ними. [6]
Повышение скорости реакций, в результате которых образуются главнейшие минералы в цементных клинкерах, полностью зависит от тепловой обработки сырьевой смеси. Поэтому обжиг сырьевой смеси для получения портландцементного клинкера производится при сравнительно высоких температурах - порядка 1300 - 1400 С. [7]
Повышение скорости реакции со временем до той или иной максимальной величины, экспериментально подтверждено и для окислов других металлов. В частности было установлено [70], что восстановление как окиси, так и закиси меди водородом протекает автокаталитически в широком интервале давлений. [8]
Повышение скорости реакции под влиянием соседнем группы, известное под названием анхи-мерная помощь, проявляется главным образом тогда, когда возможно образование Г - или ( i-звенпых колец. Так оно наблюдается у эфиров янтарной кислоты. [9]
Повышение скорости реакции в мицеллярных растворах обусловлено как увеличением концентрации, так и изменением их реакционной способности при переносе из воды ( или в общем случае из объемной фазы) в мицеллярную. Сдвиг кажущейся константы диссоциации ионного реагента под действием заряда мицеллы также играет важную роль в кинетических мицеллярных эффектах. Закономерности, полученные для водных растворов ПАВ, могут быть применены и для мицелл ПАВ в неводных средах. [10]
Повышение скорости реакции в мицеллярных растворах обусловлено как увеличением концентрации, так и изменением реакционной способности при переносе из воды ( или, в общем случае, из объемной фазы) в мицел-лярную фазу. Сдвиг константы диссоциации ионного реагента под действием поверхностного заряда мицеллы также играет важную роль в кинетических мицеллярных эффектах. Закономерности, полученные для водных растворов ПАВ, могут быть применены и для мицелл ПАВ в неводных средах. [11]
Повышение скорости реакции в мицеллярных растворах обусловлено как увеличением концентрации, так и изменением их реакционной способности при переносе из воду ( или в общем случае из объемной фазы) в мицеллярную. Сдвиг кажущейся константы диссоциации ионного реагента под действием зарядг мицеллы также играет важную роль в кинетических мицеллярных эффектах. Закономерности, полученные для водных растворов ПАВ, могут быть применены и для мицелл ПАВ в неводных средах. [12]
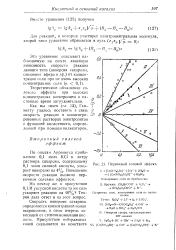 |
Первичный солевой аффект. [13] |
Повышение скорости реакции вызвано первичным солевым эффектом. [14]
Повышение скорости реакции можно также достичь увеличением числа активированных молекул путем, например, светового облучения и других факторов Однако в производственной практике этим путем пользуются очень редко. [15]
Страницы: 1 2 3 4