Еще большее повышение - температура
Cтраница 3
Иначе обстоит дело с растворами. Присутствие растворенного вещества повышает температуру кипения и понижает температуру замерзания растворителя, и тем сильнее, чем концентрированнее раствор. В большинстве случаев из раствора кристаллизуется ( при замерзании) или выкипает ( при кипении) только растворитель, вследствие чего концентрация раствора в ходе его замерзания илн кипения возрастает. Это, в свою очередь, приводит к еще большему повышению температуры кипения и снижению температуры замерзания. Таким образом, раствор кристаллизуется и кипит не при определенной температуре, а в некотором температурном интервале. Температуру начала кристаллизации и начала кипения данного раствора называют его температурой кристаллизации и температурой кипения. [31]
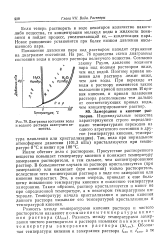 |
Диаграмма состояния воды н водного раствора нелетучего вещества. [32] |
Иначе обстоит дело с растворами. Присутствие растворенного вещества повышает температуру кипения и понижает температуру замерзания растворителя, и тем сильнее, чем концентрированнее раствор. В большинстве случаев из раствора кристаллизуется ( при замерзании) или выкипает ( при кипении) только растворитель, вследствие чего концентрация раствора в ходе его замерзания или кипения возрастает. Это, в свою очередь, приводит к еще большему повышению температуры кипения и снижению температуры замерзания. Таким образом, раствор кристаллизуется и кипит не при определенной температуре, а в некотором температурном интервале. Температуру начала кристаллизации и начала кипения данного раствора называют его температурой кристаллизации и температурой кипения. [33]
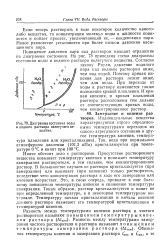 |
Диаграмма состояния воды и водного раствора нелетучего вещества. [34] |
Иначе обстоит дело с растворами. Присутствие растворенного вещества повышает температуру кипения и понижает температуру замерзания растворителя, и тем сильнее, чем концентрированнее раствор. В большинстве случаев из раствора кристаллизуется ( при замерзании) или выкипает ( при кипении) только растворитель, вследствие чего концентрация раствора в ходе его замерзания или кипения возрастает. Это, в свою очередь, приводит к еще большему повышению температуры кипения и снижению температуры замерзания. Таким образом, раствор кристаллизуется и кипит не при определенной температуре, а в некотором температурном интервале. Температуру начала кристаллизации и начала кипения данного раствора называют его температурой кристаллизации и температурой кипения. [35]
Если, например, молекулы газа занимают лишь половину предназначенного для них пространства, то в таком состоянии W не достигает своего максимального значения даже в том случае, если молекулы равномерно распределятся в пространстве. Это можно сфо рмулировать следующим образом: все термодинамические системы стремятся достигнуть состояния наибольшего разупоря-дочения. Это стремление проявляется во все большей степени по мере увеличения температуры. При достаточно высокой температуре газа его молекулы начинают ионизироваться и раз-упорядочение в системе увеличивается. При еще большем повышении температуры сложные молекулы распадаются на более простые, наконец, газ превращается в плазму - смесь ионов и электронов. [36]
Значительное влияние на смешение оказывает равномерность распределения температуры в отдельных объемах смесительной машины. Это объясняется высокой чувствительностью реологических свойств масс к температуре и связью с указанным параметром смачивающей способности связующего. С ростом температуры вальцевания увеличивается пропитываемость связующим пористых углеродных частичек. С последним обстоятельством частично связано снижение количества экстрагируемых веществ в вальцованной массе по сравнению с невальцованной. Оптимальная температура смешения с жидким связующим практически должна примерно в 2 раза превышать температуру размягчения связующего. В отдельных случаях в целях получения при смешении функциональных групп на поверхности порошков и в связующем, а также приготовления пресс-порошка заданного гранулометрического состава, неспособного к комкованию при хранении, возможно еще большее повышение температуры смешения. [37]
Мартенсит, как мы знаем ( см. параграф 24), представляет собой пресыщенный твердый раствор углерода в альфа-железе. Поэтому структура мартенсита крайне напряжена, и сталь со структурой мартенсита стремится из такого напряженного неестественного неравновесного состояния вернуться к естественному ненапряженному равновесному состоянию, а таким равновесным состоянием при температурах комнатных и других, меньших точки AI, является структура феррито-цементитной смеси. Таким образом, мартенсит всегда при всех температурах стремится распасться на феррито-цементитную смесь. Но при температурах примерно до 200 это ему не удается: слишком мала подвижность атомов при таких низких температурах. Но стоит только сталь немного нагреть ( углеродистую сталь - до температуры выше 200), как процесс распада будет происходить интенсивно. Вначале, при низких температурах ( примерно до 450), эта смесь настолько дисперсного строения, что оно неразличимо под микроскопом. Наконец, при еще большем повышении температуры - до 600 - 700 - зернышки цементита настолько укрупняются, что сорбит превращается в зернистый перлит. [38]
Испарение избытка воды дает возможность значительно сократить расход воды на охлаждение в сухих генераторах. В качестве отхода получается гашеная известь в виде порошка ( пушонка), содержащая обычно небольшое количество влаги. Воду подают в генератор через разбрызгиватели. При соприкосновении капель воды со свежей поверхностью карбида тотчас же начинается реакция. Образовавшаяся известь остается на поверхности карбида, а выделившееся тепло расходуется на испарение избытка воды, не вступившей в реакцию, а также на нагревание карбида, извести и ацетилена. Последующие капли воды, прежде чем вступить в реакцию с карбидом, должны проникнуть через слои извести. При этом они несколько охлаждают известь и в значительной степени испаряются. Остаток воды взаимодействует с карбидом; образовавшийся при этом ацетилен в смеси с водяным паром проходит через слой извести. Под действием каждой последующей капли воды слой извести увеличивается, поэтому гидролиз карбида все больше замедляется. С увеличением толщины слоя извести скорость отвода тепла уменьшается, поэтому зона разложения карбида под коркой извести не будет охлаждаться. Находящийся в этой зоне водяной пар вступает в реакцию с карбидом, что приводит к еще большему повышению температуры в зоне реакции, при этом может быть достигнута температура инициирования распада ацетилена. [39]
Страницы: 1 2 3