Дальнейшее повышение - концентрация - соль
Cтраница 1
Дальнейшее повышение концентрации соли до 600 г / л не изменяет характер поляризационных кривых. По-видимому, образующееся в электролите соединение комплексного типа влияет на физико-механические и магнитные свойства никелевых осадков. Для получения образцов были использованы электролиты, содержащие, кроме сульфаминовокислого никеля, 10 г / л хлористого никеля и 30 г / л борной кислоты; рН 3 5; iK 20 А / дм2; ta 60 С. [2]
Дальнейшее повышение концентрации соли в растворе уменьшает скорость коррозии вследствие уменьшения растворимости кислорода. Концентрация раствора, которой отвечает максимум на кривой, зависит от свойств металлов и солей. [3]
Дальнейшее повышение концентрации соли затем уменьшает скорость коррозии металлов. Несомненно, это понижение кривой вызвано уменьшением растворимости кислорода с повышением концентрации соли в растворе. [4]
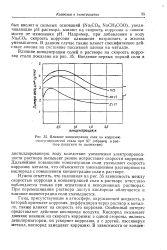 |
Влияние концентрации соли на коррозию малоуглеродистой стали при 35 ( образец в раствор погружен не полностью. [5] |
Дальнейшее повышение концентрации соли уменьшает скорость коррозии металла, что объясняется уменьшением растворимости кислорода с повышением концентрации соли в растворе. [6]
Максимальная скорость коррозии достигается при увеличении концентрации солей до 2 - 7 %, при дальнейшем повышении концентрации солей скорость коррозии понижается за счет уменьшения растворимости кислорода и других кислых, газов - сероводорода, двуокиси углерода. Это изменение концентрации сероводорода без учета влияния ионов хлора на коррозионный процесс должно было бы привести к замедлению скорости коррозии. Максимум скорости коррозии и водородопроницаемости приходится примерно на 2 - 3 % минерализации, а увеличение концентрации NaCl более 3 % приводит к заметному торможению водопроницаемости и скорости коррозии, которые меняются симбатно. Таким образом, влияние NaCl на скорость коррозии и водородопроницаемость двоякое в зависимости от его содержания. [7]
Концентрация соли в растворе по-разному влияет на коррозию, во многом это зависит от природы самой соли. Дальнейшее повышение концентрации соли понижает скорость коррозии металлов вследствие уменьшения растворимости деполяризатора-кислорода в коррозионной среде. [8]
Для одного и того же металла скорость коррозии различна в различных электролитах. В растворах солей скорость коррозии при повышении концентрации вначале увеличивается, а затем, при дальнейшем повышении концентрации соли выше определенного предела, скорость коррозии падает. Это явление объясняется уменьшением растворимости кислорода в растворе при повышении концентрации соли. [9]
Ион натрия должен как бы экранировать отрицательный заряд карбоксильной группы, и сорбция аминокислоты должна усилиться. Но это усиление с повышением концентрации соли должно достигнуть максимума, и затем вновь начнется уменьшение сорбции, так как с дальнейшим повышением концентрации соли усилится конкуренция за сорбционные места между ионами аминокислоты и неорганическими катионами. [10]
Это свойство используется при фракционировании смеси белков. Добавлением определенного количества соли осаждают часть загрязняющих белков и удаляют эти белки центрифугированием. Дальнейшее повышение концентрации соли может привести уже к осаждению нужного белка вместе с некоторой частью оставшихся загрязняющих белков. Очищенный белок ( вместе с другими белками, выпавшими в осадок после второго добавления соли) отделяют центрифугированием. Удобнее всего применять для такого осаждения белков сульфат аммония, однако нередко для этой цели используется также сульфат натрия. [11]
В условиях осаждения гидроокиси магния количество адсорбированных ОН-ионов незначительно. Положительный заряд гидроокиси образуется за счет ионов Mg, адсорбируемых поверхностью гидроокиси в избытке. Максимальная адсорбция катионов на поверхности, повидимому, достигается при очень низких концентрациях электролитов. Дальнейшее повышение концентрации соли не повышает адсорбцию, в связи с чем заряд остается почти неизменным. Отличие внутреннего строения мицелл гидроокиси, полученной в условиях избытка соли, состоит в том, что, кроме ионов Mg, адсорбированных на поверхности, она содержит определенное количество ионов Mg, находящихся в составе неионизированной части гидроокиси, входящих в состав ее мицелл и составляющих с ними одно целое. [12]
О том, как влияют электролиты на адсорбцию ПАВ микропористыми и переходнопористыми адсорбентами, к которым относятся и активные угли, известно очень мало. На рис. 56 показано влияние минеральных солей на адсорбцию из водного раствора ОП-10 активным антрацитом. Эти данные показывают, что повышение концентрации солей примерно до 0 01 г-экв / л приводит к увеличению динамической адсорбционной емкости активного антрацита в 1 4 - 1 8 раза. Дальнейшее повышение концентрации соли в растворе ОП-10 вызывает, однако, резкое уменьшение емкости активного антрацита. Причиной этого является резкое падение концентрации неассоциированных молекул в растворе с увеличением фактора ассоциации сверх некоторого предельного значения, а следовательно, и уменьшение равновесного значения удельной адсорбции. [13]
Страницы: 1
