Дальнейшее повышение - концентрация - электролит
Cтраница 1
Дальнейшее повышение концентрации электролита приводит к появлению второй зоны неустойчивости системы, связанной с групповой коагуляцией. [1]
Дальнейшее повышение концентрации электролита, как это было показано на примере водного раствора хлорида натрия, приводит к некоторому замедлению спада диэлектрической постоянной и отклонению экспериментальной кривой от прямой линии в сторону больших величин диэлектрической постоянной. Предполагается, что такой ход кривых D - с обусловлен наложением эффектов упорядочения структуры воды и ее разрушения под действием введенных ионов. Если рассматривать воду как систему, состоящую из квазикристаллических образований, распределенных в аморфной жидкости, то при введении первых порций электролита наиболее заметно проявляются их упорядочивающее действие - образование внутреннего сольватного ( замороженного) слоя молекул воды, частичная ориелтация молекул воды во внешнем сольватном слое; уменьшение свободного объема жидкости. Все эти эффекты охватывают главным образом преобладающую аморфную форму воды, связь между молекулами в которой ниже, чем в квазикристаллических образованиях, и приводят к уменьшению энтропии. При возрастании концентрации электролита, когда значительная часть аморфной воды уже связана, в формирование гидратных оболочек вовлекаются квазикристаллические образования, их упорядоченность снижается, а энтропия возрастает. [2]
 |
Диаграмма фазовых превращений мыльного клея под действием электролитов. [3] |
При дальнейшем повышении концентрации электролита до 3 5 % из системы полностью исчезает клеевая фаза; мыльная масса в это время состоит примерно из 70 % ядровой фазы и 30 / 0 водной. В этой точке ( 3) концентрация электролита в водной фазе достигает предельной. [4]
При дальнейшем повышении концентрации электролитов в мыльной массе содержание мыла и электролитов в ядровой фазе также увеличивается и одновременно повышается ее вязкость. Изменения, происходящие в клеевой фазе, заключаются в том, что в ней уменьшается содержание мыла и увеличивается содержание электролитов. При этом плотность клеевой фазы повышается, а вязкость снижается. [5]
Практически установлено, что при дальнейшем повышении концентрации электролитов в мыльной массе, например до уровня, при котором образуются три фазы ( ядровая, клеевая и водная), время разделения ядровой и клеевой фаз снова увеличивается. [6]
Такой вывод косвенно подтверждается слабо выраженным и почти линейным уменьшением диэлектрической проницаемости раствора при увеличении концентрации электролита вплоть до 0 5 - 1 0 М растворов. Дальнейшее повышение концентрации электролита приводит к некоторому замедлению спада диэлектрической проницаемости и отклонению экспериментальной кривой от прямой линии в сторону больших величин диэлектрической проницаемости. Предполагается, что такой ход кривых е - с обусловлен наложением эффектов упорядочения структуры воды и ее разрушения под действием введенных ионов. Если рассматривать воду как систему, состоящую из квазикристаллических образований, то при введении первых порций электролита наиболее заметно проявляется их упорядочивающее действие - образование внутреннего сольватного ( замороженного) слоя молекул воды, частичная ориентация молекул воды во внешнем сольватном слое, уменьшение свободного объема жидкости. Все эти эффекты охватывают главным образом преобладающую аморфную форму воды, связь между молекулами в которой слабее, чем в квазикристаллических образованиях, и приводят к уменьшению энтропии. [7]
Такой вывод косвенно подтверждается слабо выраженным и почти линейным уменьшением диэлектрической проницаемости раствора при увеличении концентрации электролита вплоть до 0 5 - 1 0 М растворов. Дальнейшее повышение концентрации электролита приводит к некоторому замедлению спада диэлектрической проницаемости и отклонению экспериментальной кривой от прямой линии в сторону больших величин диэлектрической проницаемости. Предполагается, что такой ход кривых к - с обусловлен наложением эффектов упорядочения структуры воды и ее разрушения под действием введенных ионов. Если рассматривать воду как систему, состоящую из квазикристаллических образований, то при введении первых порций электролита наиболее заметно проявляется их упорядочивающее действие - образование внутреннего сольватного ( замороженного) слоя молекул воды, частичная ориентация молекул воды во внешнем сольватном слое, уменьшение свободного объема жидкости. Все эти эффекты охватывают главным образом преобладающую аморфную форму воды, связь между молекулами в которой слабее, чем в квазикристаллических образованиях, и приводят к уменьшению энтропии. [8]
 |
Сравнительные значения.| Зависимость удельной электрической. [9] |
Зависимость, удельной проводимости от концентрации электролитов представлена на рис. 27.3. В очень разбавленных растворах при повышении концентрации как сильных, так и слабых электролитов их проводимость возрастает, поскольку увеличивается общее число ионов. При дальнейшем повышении концентрации электролитов проводимость уменьшается. В растворах сильных электролитов это обусловлено возникновением тормозящих ( электрофоретического и релаксационного) эффектов взаимодействия заряженных частиц ионной системы. У слабых электролитов увеличение концентрации способствует резкому снижению их степени диссоциации, а следовательно, и уменьшению числа ионов, участвующих в переносе электричества. [10]
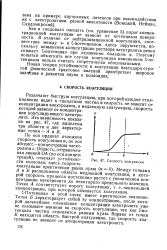 |
Скорость коагуляции. [11] |
С-Потенциал в этой точке имеет критическое значение. Точка Б характеризует собой ту концентрацию после которой дальнейшее повышение концентрации электролита уже не оказывает влияния на скорость коагуляции, так как С-потенциал частиц становится равным нулю. Вправо от точки Б находится область быстрой коагуляции, где скорость коагуляции не зависит от концентрации электролита. [12]
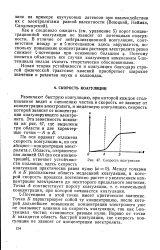 |
Скорость коагуляции. [13] |
С-Потенциал в этой точке имеет критическое значение. Точка Б характеризует собой ту концентрацию, после которой дальнейшее повышение концентрации электролита уже не оказывает влияния на скорость коагуляции, так как С-по-тенциал частиц становится равным нулю. Вправо от точки Б находится область быстрой коагуляции, где скорость коагуляции не зависит от концентрации электролита. [14]
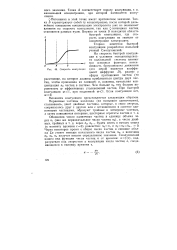 |
Скорость коагуляции. [15] |
Страницы: 1 2