Поглощение - катион
Cтраница 2
 |
Емкость поглощения у разных почв и содержание гумуса ( по Н. П. Ремезову. [16] |
Емкость поглощения катионов у разных почв различна ( табл. 21) в зависимости от общего содержания мелкодисперсной коллоидной фракции, количества и состава органического вещества, химического и минералогического состава минеральных коллоидных частиц и реакции почвенного раствора. [17]
Емкость поглощения катионов и анионов естественных адсорбентов невелика, и они не нашли широкого применения в опытах по выращиванию растений в регулируемых условиях. С открытием искусственных высокомолекулярных синтетических ионообменных смол делаются попытки их практического использования для целей выращивания растений. [18]
 |
Емкость поглощения у разных почв и содержание гумуса ( по Н. П. Ремезову. [19] |
Емкость поглощения катионов у разных почв различна ( табл. 21) в зависимости от общего содержания мелкодисперсной коллоидной фракции, количества и состава органического вещества, химического и минералогического состава минеральных коллоидных частиц и реакции почвенного раствора. [20]
 |
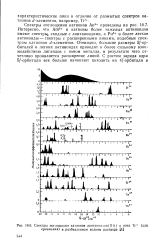
Форма / - орбиталей z3 и хуг [ 101. [21] |
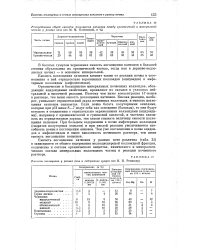
Спектры поглощения катионов Ln3 показаны на рис. 16.6. Эти спектры обусловлены f - / - переходами, аналогичными d - d - переходам для катионов d - элементов. В противоположность последним 4 / - орбитали лантаноидов лежат в атоме глубже и уширяющее линии влияние лигандов сведено у них к минимуму. [22]
 |
Спектры поглощения катионов лантаноидов ( Ш и иона Ti3 ( для сравнения в разбавленном водном растворе. [23] |
Спектры поглощения катионов Ап34 приведены на рис. 16.7. Интересно, что Ат3 и катионы более тяжелых актиноидов имеют спектры, сходные с лантаноидами, а Ри3 и более легкие актиноиды - спектры с расширенными пиками, подобные спектрам катионов uf - эл. Очевидно, большие размеры 5 / - ор-биталей в легких актиноидах приводят к более сильному взаимодействию лигандов с ионом металла, в результате чего отчетливо проявляется расширение линий. [24]
При поглощении катионов на катионите устанавливается подвижное равновесие, которое сдвигается в зависимости от изменения рН воды в процессе катионного обмена и изменения концентрации катионов металлов. [25]
Возрастание энергии поглощения катионов с увеличением их атомного веса объясняется тем, что с ростом атомного веса и размера катионов уменьшается степень их гидратации. [26]
Благодаря эквивалентности поглощения катионов и анионов молекулы электролитов в подобных случаях адсорбируются целиком. [27]
Возрастание энергии поглощения катионов с увеличением их атомного веса объясняется тем, что с ростом атомного веса и размера катионов уменьшается степень их гидратации. Так, негидратированные одновалентные катионы имеют следующие радиусы ( в A): Li - 0 78, Na - 0 98, NH4 - 1 43, К - 1 33, а размер этих катионов с гидратационной оболочкой равен соответственно ( по Иенни): 10 03; 7 9; 5 37; 5 32; Чем больше величина иона без гидратационной оболочки, тем меньше его размер в гидратированном состоянии. Слабо гидратированные катионы сильнее притягиваются поверхностью коллоида. Наличие большой гидратационной оболочки уменьшает энергию поглощения катиона. Поэтому чем менее гидратирован катион, тем прочнее его удерживает коллоидная частица и тем легче он вытесняет из поглощенного состояния более гидратированные ( и поэтому слабее удерживаемые) катионы. По возрастающей способности к поглощению катионы располагаются в следующий ряд: одновалентные LiNa NH4 KRb; двухвалентные Mg Са Со; трехвалентные Al Fe. Исключение составляет водородный ион. Он имеет наименьший атомный вес, но обладает высокой энергией поглощения и способностью вытеснять из поглощающего комплекса другие катионы. Объясняется это тем, что в водных растворах ион водорода, присоединяя одну молекулу воды, образует ион гидроксония Н30, который имеет диаметр 1 35 А, значительно меньше, чем все другие гидратированные ионы, поэтому он поглощается сильнее одновалентных и даже двухвалентных катионов. [28]
Максимум полосы поглощения катионов арилдиазония с заместителями СНз, С1, СНзО, ОН и NR R сдвигается в сторону длинных волн в соответствии с электронодонорной силой этих групп. [29]
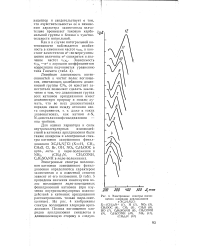 |
Электронные спектры поглощения хлоридов арилдиазония. [30] |
Страницы: 1 2 3 4