Термическая подвижность
Cтраница 1
Термическая подвижность граничных слоев влаги в торфяных системах при UiUK снижается. Это дает основание предположить, что в области влажного состояния торфяных систем транспорт влаги и ионов ТСВ происходит в определенной степени автономно и не зависит от содержания капиллярной ( свободной) воды в них. [1]
 |
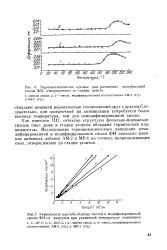
Влияние рН и влагосодер-жания торфяной почвы ( d2 мм на изменение термоградиентного коэффициента б. [2] |
Изменения термической подвижности воды в дисперсных материалах в определяющей мере обусловлены различной толщиной смачивающих пленок воды на поверхностях с разной плотностью заряда. [3]
 |
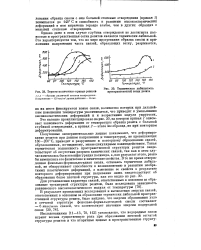
Термомеханпческпе кривые для различных модификаций смолы ФН, отвержденных до стадии резита. [4] |
Как известно fill, сетчатые структуры фенольно-формальде-гидиых смол даже в стадии резитов обладают термической подвижностью. [5]
 |
Термомеханические кривые резитов.| Термическая лабильность пространственной сетки резита. [6] |
Полученные экспериментальные данные показывают, что деформирование резитов при данном напряжении и температурах, не превышающих 180 - 200 С, приводит к разрушению и повторному образованию связей, обусловленных, по-видимому, межмолекулярным взаимодействием. Такая термическая подвижность пространственной структуры резитов свидетельствует об отсутствии разрыва химических связей, так как в этом случае изменялась бы вся конфигурация полимера, а, как результат этого, резко бы изменялись его физические и химические свойства. [7]
Под действием нагрузки межмолекулярные связи резола могут разрушаться, а при снятии нагрузки вновь восстанавливаться. Даже для резита пространственная сетка не является стабильной: для нее характерна термическая подвижность. [8]
Наличие водородных связей в структуре полимеров сетчатого строения обусловливается существованием сильных диполъных групп в полимерных цепях, способных к образованию пространственных структур. Эти водородные связи способны разрываться и вновь образовываться при повышенных температурах, обусловливая термическую подвижность таких структур. Когда температура повышается до такого предела, что количество образующихся дополнительных связей будет увеличиваться, то динамический обмен вторичных связей будет нарушен и сетчатая структура полимера приобретет большую плотность. [9]
Наличие водородных связей в структуре полимеров сетчатого строения обусловливается существованием сильных дипольных групп в полимерных цепях, способных к образованию пространственных структур. Эти водородные связи способны разрываться и вновь образовываться при повышенных температурах, обусловливая термическую подвижность таких структур. Когда температура повышается до такого предела, что количество образующихся дополнительных связей будет увеличиваться, то динамический обмен вторичных связей будет нарушен и сетчатая структура полимера приобретет ббльпгую плотность. [10]
 |
Дислокационная структура деформированной стали. Х25000. [11] |
Деформации в этой зоне вызываются сдвигом путем проскальзывания - смещения зерен относительно друг друга, а также внутризеренной пластической деформацией в результате дробления зерен на субзерна и скольжения. Дислокации концентрируются в полосах скольжения и субграницах. При удалении от шва в связи с уменьшением температуры термическая подвижность дислокаций резко снижается и затрудняются процессы возврата и аннигиляции дислокаций. В результате образуется более высокая плотность дислокаций, чем в металле шва и прилегающей к шву зоне термического влияния, где одновременно с пластической деформацией интенсивно протекают процессы релаксации. Эта зона характеризуется развитием пластической деформации путем внутризеренного скольжения и в связи с этим дислокации сосредоточены в основном в полосах скольжения. Далее идет основной металл с исходной дислокационной структурой. [12]
На основании этих фактов предлагается следующий механизм процесса регенерации. Во время регенерации атомам и ионам металла сообщается тепловая энергия, требуемая для ухода с поверхности раздела металл - окисел и реакции с анионами кислорода, оставшимися на поверхности. Так как регенерация проводится в высоком вакууме и дальнейший приток кислорода исключен, электрический потенциал в толще пленки уничтожается. Благодаря возрастающей термической подвижности вакантные узлы решетки на поверхности раздела металл - окисел заполняются либо окисью, двигающейся внутрь, либо атомами металла, двигающимися наружу. Таким образом, снова создаются условия для возникновения сильного поля при очередной хемосорбции кислорода на регенерированной поверхности. [13]
Сила связи ионов определяется их размерами и деформируемостью. Сравнивая, например, проводимость нат-риево-известкового силикатного стекла с проводимостью кристалла хлористого натрия, Смекал показал, как число свободных ионов в стекле становится выше числа ионов, с большим трудом перемещающихся со своих мест. В кристалле же каменной соли гораздо более многочисленны последние ионы. Разница между свободными ионами, осуществляющими одностороннюю проводимость, и ионами, участвующими в переносе электрического тока лишь при сравнительно высоких температурах35, таким образом, определяется энергией молекулярной термической подвижности. [14]
Рао отмечает, что дипольная реакция имеет место и в растворе NaOH более низкой концентрации, но при более низкой температуре. Так, например, хлопковые волокна мерсеризуются 2 % - м NaOH при 0 С. Молекулы воды при 0 С образуют комплексы большего размера ( координационное число может достигать 6); они имеют высокие дипольные моменты. Гидроксильные ионы, будучи гидратированными такими молекулярными комплексами, характеризуются значительно увеличенной электроотрицательностью своих кислородных атомов. Сила электрического поля уменьшается при 0 С почти вдвое. Термическая подвижность комплексов находится в минимуме и обеспечивает максимум антипараллельной ориентации комплексов. При этом высоко электроотрицательные кислородные атомы комплексов гидроксил-ион - вода образуют водородные связи с Н - атомами ОН-группы в целлюлозе, вызывая ее диспергирование в растворе. Большее количество дипольных комплексов наводняет целлюлозу водородными связями и может приводить к ее растворению. [15]
Страницы: 1