Закись-окись - кобальт
Cтраница 2
Согласно опубликованным данным [840, 841], реакция окисления аммиака на платиновых сетках и на неплатиновых катализаторах ( закись-окись кобальта) протекает во внешне-диффузионной области. [16]
Промытый и высушенный осадок прокаливают при 800 - 900 С до постоянного веса, охлаждают и полученную закись-окись кобальта взвешивают. [17]
В фарфоровый тигель загружают 112 г окиси кобальта ( в расчете на Со2Оз) или 109 г закись-окиси кобальта ( в расчете на СозО4) и помещают в вакуумную электропечь. Повышают температуру в реторте печи до 850 и одновременно откачивают воздух из реторты форвакуумным насосом до 0 2 - 0 5 мм. При этих условиях выдерживают навеску в течение 60 - 90 минут. В обычных условиях закись кобальта практически не окисляется воздухом и разгрузка печи может производиться ( - ез особых предосторожностей. [18]
Из кислородных соединений кобальта изучены: СоО ( серо-зеленого цвета) - закись кобальта; Со2О3 ( темно-коричневого цвета) - окись кобальта; Со3О4 ( СоО Со2О3) ( темно-бурого цвета) - закись-окись кобальта. [19]
При определении паров бензина исследуемая паро-воздушная смесь подается в систему подготовки газа, в которой проходит через патрон, содержащий смесь натронной извести и гранулированного едкого натра ( 10 %) при 100 С для очистки от кислых газов, затем пары бензина проходят через трубку с катализатором ( закись-окись кобальта), нагреваемую электрической печью до 380 20 С. [20]
При определении паров бензина исследуемая паро-воздушная смесь подается в систему подготовки газа, в которой проходит через патрон, содержащий смесь натронной извести и гранулированного едкого натра ( 10 %) при 100 С для очистки от кислых газов, затем пары бензина проходят через трубку с катализатором ( закись-окись кобальта), нагреваемую электрической печью до 380 20 С. [21]
Вечержа [6, 7] предложил метод автоматического определения углерода, водорода, азота, в котором хроматографическая колонка заменена химическими поглотителями. В качестве окислителя использована закись-окись кобальта при температуре 600 - 700 С. Для определения каждого элемента применялся соответствующий газ-носитель. При определении углерода сожжение проводят в токе кислорода. Образующуюся воду и окислы азота поглощают ангидроном и двуокисью марганца, а двуокись углерода определяют по теплопроводности. При определении водорода вещество сжигают в токе азота; воду восстанавливают железными стружками до водорода; после поглощения двуокиси углерода водород фиксируют катарометром. При определении азота вещество сжигают в токе СС2, элементарный азот определяют также по теплопроводности. [22]
Полученную после прокаливания осадка нитрозонафтолата кобальта закись-окись кобальта прокаливают 20 - 30 мин. [23]
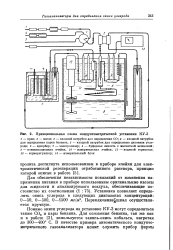 |
Принципиальная схема кондуктометрической установки КУ-3. [24] |
Помимо окиси углерода на установке КУ-3 могут определяться также С02 и пары бензина. Для сожжения бензина, так же как и в работе [3], используется закись-окись кобальта, нагретая до 300 - 400 С. [25]
Рассмотренный в работе материал иллюстрирует также основное, принципиальное ограничение термодинамического метода предвидения каталитической активности, связанное с тем, что критерий ( 1) не определяет абсолютной каталитической активности. В пределах каждой такой группы выполняется принцип энергетического соответствия и имеется свой оптимальный катализатор, например платина среди переходных металлов и закись-окись кобальта - среди простых окислов. В то же время абсолютная каталитическая активность катализаторов, в одинаковой степени отвечающих критерию оптимума, но принадлежащих к разным группам, отличается на несколько порядков. Это свидетельствует о различиях в элементарном механизме одного и того же каталитического процесса на катализаторах разной природы. В данном случае эти различия связаны, по-видимому, с особенностями активации молекулярного водорода на переходных металлах, непереходных металлах и окислах. [26]
В литературе [55] указывается, что можно достигнуть почти полного окисления аммиака ( около 99 2 %) до окиси азота [104, 63] в присутствии катализатора, представляющего тонкую проволоку, состоящую из сплава платины, родия и кобальта, предварительно прокаленную в течение приблизительно 30 минут при температуре около 1100 и промытую соляной кислотой; содержание кобальта должно быть выше содержания родия. Другой способ, предложенный для приготовления кобальтового катализатора для окисления аммиака, описан следующим образом [28]: 70 частей неочищенного кобальта нагревают с 3 5 - 5 0 частями углекислого кальция и 1 7 - 3 5 частями фтористого кальция до плавления. Металл отделяют от шлака и превращают в закись - окись кобальта, размельчают в порошок, проходящий через сито в 100 меш, смешивают с 17 - 19 % по весу угля и смесь обрабатывают раствором сахара ( 1 часть сахара на 5 частей воды) для образования густой пасты: раствор сахара применяют в количестве 6 частей на 15 частей закись-окиси кобальта. Из этой пасты формуют крупные зерна, высушивают их и затем восстанавливают в жидкий металл, который покрывается смесью окиси кальция и фтористого кальция. [27]
Так, окись железа в различных условиях плавления, а отчасти в комбинации с другими соединениями дает желтый, красный, коричневый, серый и черный цвета и другие оттенки. Окись марганца дает фиолетовый, коричневый, серый и черный цвета. Окись меди дает целую гамму синих и зеленых цветов и оттенков, отличающихся однако от чисто зеленого цвета. Закись-окись кобальта окрашивает стекла в чисто синий цвет различных оттенков, а в смеси с другими окислами дает фиолетовый, серый и черный цвета. Специальный кобальтовый краситель, называемый смальтой, дают силикаты калия и кобальта. Окись хрома обычно дает чисто зеленый цвет; другие соединения хрома ( хромпик и хромокислый свинец) - специальную розовую окраску, известную под названием п и н к, и яркокрас-ную - коралл, а также коричневый цвет. [28]
Соли двухвалентного кобальта дают со щелочами осадок гидроокиси кобальта Со ( ОН) 2, цвет которого сначала синий, а затем быстро переходит в светло-красный. При нагревании этого осадка или карбоната кобальта ( П) получают окись кобальта СоО оливково-зеленого цвета. На воздухе гидроокись кобаль-та ( П) окисляется до гидроокиси Со ( ОН) 3 или СоО ( ОН), окрашенной в бурый цвет. При дегидратации в специальных условиях можно получить окись кобальта Со2О3 бурого цвета, легко выделяющую кислород с переходом в закись-окись кобальта Со3О4, окрашенную в черный цвет. Закись-окись получают и сжиганием металлического кобальта при высокой температуре. [29]
Выделяющийся кислород разбрасывает реакционную массу и перемешивает продукты реакции, что мешает осаждению получаемого металла на дно тигля. Поэтому эти окислы нельзя применять для получения марганца или его сплавов. Частичное разложение и испарение наблюдается при алюминотермическом восстановлении хромового ангидрида, поэтому данный окисел также нельзя непосредственно использовать для алюмино-термического получения хрома. Но окисел можно использовать в качестве добавки к трудновосстанавливаемым окислам, поскольку при восстановлении хромового ангидрида выделяются большие количества теплоты. Однако эта добавка не должна составлять более 10 - 15 % от массы другого окисла. Некоторое испарение происходит при металлотермическом восстановлении молибденового ангидрида и частичное разложение при восстановлении закись-окиси кобальта. Но эти окислы можно использовать как для получения соответствующих металлов, так и в качестве добавок к различным окислам с целью получения сплавов. [30]
Страницы: 1 2