Подоболочка
Cтраница 4
Не она заложена в законченности подоболочки 1 52-электронов, а для последовательности Ne - Rn в законченности подо-болочек прв. В атомах как Не, так и Ne отсутствуют одиночные электроны и это их в известном смысле сближает. [46]
Между тем истинная последовательность построения электронных подоболочек по мере роста Z - действительная реальная схема ( ДРС) - оказывается более сложной, ибо, во-первых, наблюдаются отклонения от монотонности заполнения га, Z-подгрупп и, во-вторых, нарушаются границы между некоторыми соседними га, Z-подгруппами. Таким образом, отклонения от строгой упорядоченности множества связаны с закономерностями формирования электронных конфигураций атомов в соответствии с ДРС. [47]
Числа электронов в оболочках и подоболочках определяются на основании Паули принципа. Емкости оболочек и подоболочек равны соотв. [48]
Именно ограничение числа электронов на подоболочках и оболочках определяет периодичность свойств элементов. [49]
В элементах Rb и Sr заполняется подоболочка ( 5 0), и они обладают свойствами щелочного и щелочноземельного металлов. Они аналогичны десяти элементам от Sc до Zn предыдущей группы. [50]
Напротив, построение 5 / - подоболочки не означает завершения электронной оболочки. [51]
J L - S, если электронная подоболочка заполнена менее чем наполовину, или значение y L 5, если электронная подоболочка заполнена более чем наполовину. [52]
Из них следует также, что полностью заполненные подоболочки, для которых L и S равны нулю, не вносят вклада в собственный магнитный: момент электронной оболочки атома. [53]
Ядерная же оболочка должна объединять группу подоболочек, отделенных от других оболочек достаточно широким энергетическим интервалом. [54]
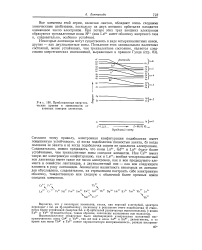 |
Приближенные энергети. [55] |
Согласно этому правилу, электронная конфигурация подоболочки имеет повышенную устойчивость, а) когда подоболочка полностью занята, б) когда половина ее занята и в) когда подоболочка совсем не заполнена электронами. Следовательно, можно предвидеть, что ионы La3, Gd3 и Lu3 будут более устойчивыми, чем трехвалентные ионы соседних элементов. Ион Се4 имеет такую же электронную конфигурацию, как и La3; вообще четырехвалентный ион лантанида имеет такое же число электронов, как и ион предыдущего элемента в семействе лантанидов, а двухвалентный ион - как ион следующего элемента в ряду лантанидов. Аномальная валентность некоторых из лантанидов обусловлена, следовательно, их стремлением построить себе электронную оболочку, тождественную или сходную с оболочкой более прочных ионов соседних элементов. [56]
 |
К возможному набору значений магнитного квантового числа. Стрелками показаны допустимые направления орбитального момента количества движения. 3J i Q 1 2 z. [57] |
Орбитальное квантовое число влияет на энергию электронных подоболочек в многоэлектронных атомах ( см. разд. [58]
Для элементов IV побочной подгруппы изменение электронных подоболочек вследствие увеличения их числа при переходе от Zr к Hf компенсируется влиянием релятивистских эффектов. Поэтому эти два элемента очень близки по свойствам. [59]
Страницы: 1 2 3 4