Вакантные подуровни
Cтраница 1
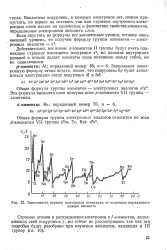 |
Зависимость первого потенциала ионизации от величины порядкового. [1] |
Вакантные подуровни, в которых электронов нет, можно пропустить, но вернее их оставить, так как строение внутренних электронных слоев влияет на химические и физические свойства элементов, определяемые электронами внешнего слоя. [2]
В то же время при наличии вакантных подуровней у одного и того же уровня ( нкв - const) распаривание электронов и переход их на вакантные подуровни требует значительно меньшей затраты энергии. [3]
При возбуждении атомов электроны могут переходить на вакантные подуровни с других ( занятых электронами) подуровней данного энергетического уровня или даже из нижележащих уровней. Примеры будут рассмотрены ниже при изучении вопроса о сущности химической связи ( гл. [4]
Физические свойства марганца резко отличаются от свойств других металлов: отсутствие вакантных подуровней при наполовину законченном подуровне d обусловливает устойчивость его электронной оболочки, что в свою очередь приводит к уменьшению металлических свойств и снижению концентрации электронов проводимости. [5]
Физические свойства марганца резко отличаются от свойств других металлов; отсутствие вакантных подуровней при наполовину законченном подуровне d обусловливает устойчивость его электронной оболочки, что в свою очередь приводит к уменьшению металлических свойств и снижению концентрации электронов проводимости. [6]
Физические свойства марганца резко отличаются от свойств других d - металлов: отсутствие вакантных подуровней при наполовину законченном подуровне d обусловливает устойчивость его электронной оболочки, что, в свою очередь, приводит к уменьшению металлических свойств и снижению концентрации электронов проводимости. Полиморфные превращения марганца в этом отношении характерны: а - Мп - сложный куб из 31 атома, ( З - Мп - сложный куб из 29 атомов имеют неметаллические структуры кристаллических решеток и только - у - Mn и 8 - Мп - типичные металлические структуры, напоминающие y - Fe и 8 - Fe. [7]
Атомы элементов этой подгруппы имеют совпадающие по строению валентные подуровни ( ns2nps), различные электронные остовы и вакантные подуровни. Два электрона валентных s - подуровней спарены, три электрона р-подуровней заселяют орбитали этих подуровней по одному. Электронная структура азота выделяется отсутствием вакантных подуровней, энергетически близких к наполовину заполненному 2р - подуровню. У фосфора есть один вакантный d - подуровень, а мышьяк, сурьма и висмут имеют несколько вакантных подуровней, близко расположенных к валентным подуровням. [8]
В то же время при наличии вакантных подуровней у одного и того же уровня ( нкв - const) распаривание электронов и переход их на вакантные подуровни требует значительно меньшей затраты энергии. [9]
Руководствуясь табл. 2.8 и порядком заполнения подуровней в 4 - м периоде, написать такую формулу не составляет особого труда. Вакантные подуровни, в которых электронов нет, можно пропустить, но вернее их оставить, так как строение внутренних электронных слоев влияет на химические и физические свойства элементов, определяемые электронами внешнего слоя. [10]
В этом же направлении усиливаются металлические свойства. Некоторые особенности свойств каждого из элементов подгруппы могут быть объяснены различиями в строении электронных остовов и наличием вакантных подуровней. Атом углерода выделяется отсутствием вакантных подуровней, близко расположенных к валентным подуровням 2s и 2р, у кремния есть вакантный Sd-подуровень, а у атомов остальных элементов подгруппы по два близко расположенных вакантных подуровня. [11]
В этом же направлении усиливаются металлические свойства. Некоторые особенности свойств каждого из элементов подгруппы могут быть объяснены различиями в строении электронных остовов и наличием вакантных подуровней. Атом углерода выделяется отсутствием вакантных подуровней, близко расположенных к валентным подуровням 2s и 2р, у кремния есть вакантный Sd-подуровень, а у атомов остальных элементов подгруппы по два близко расположенных вакантных подуровня. [12]
Атомы элементов этой подгруппы имеют совпадающие по строению валентные подуровни ( ns2nps), различные электронные остовы и вакантные подуровни. Два электрона валентных s - подуровней спарены, три электрона р-подуровней заселяют орбитали этих подуровней по одному. Электронная структура азота выделяется отсутствием вакантных подуровней, энергетически близких к наполовину заполненному 2р - подуровню. У фосфора есть один вакантный d - подуровень, а мышьяк, сурьма и висмут имеют несколько вакантных подуровней, близко расположенных к валентным подуровням. [13]
К важной особенности - элементов относится образование кова-лентной связи между соседними атомами за счет с / - электронов, что существенно влияет на свойства этих металлов. Так как число d - электронов изменяется по периоду, то соответственно изменяются физические и химические свойства металлов. С увеличением порядкового номера элемента в одной и той же группе периодической системы изменяется электронная структура металлов в силу нескольких причин: появления вакантных подуровней ( сначала /, а затем и g), проникновения s - электронов под экран d -, а затем d - и / электронов / - сжатия в шестом периоде. Поэтому свойства J-металлов пятого и шестого периодов заметно отличаются от свойств элементов четвертого периода. [14]
Атомы элементов этой подгруппы имеют совпадающие по строению валентные подуровни ( ns2nps), различные электронные остовы и вакантные подуровни. Два электрона валентных s - подуровней спарены, три электрона р-подуровней заселяют орбитали этих подуровней по одному. Электронная структура азота выделяется отсутствием вакантных подуровней, энергетически близких к наполовину заполненному 2р - подуровню. У фосфора есть один вакантный d - подуровень, а мышьяк, сурьма и висмут имеют несколько вакантных подуровней, близко расположенных к валентным подуровням. [15]
Страницы: 1