Атом-атомный подход
Cтраница 1
Атом-атомный подход в принципе может являться ключом к пониманию роли межмолекулярных взаимодействий как в жидкости, так и в кристалле. Но трудность его применения к жидкой фазе заключается в том, что для оценки относительной стабильности конформеров требуется найти минимумы свободной энергии системы молекула растворенного вещества - молекулы растворителя. [1]
Справедливость атом-атомного подхода к расчету взаимодействия сложных молекул и предположение об аддитивности этих взаимодействий по атомам к настоящему времени достаточно надежно показана на примере вычисления свойств органических молекулярных кристаллов. Для метана теория и опыт дают 2 4 ккал / молъ, а соответствующие числа для адаман-тана - 15 5 и 12 7, для бензола - 10 5 и 10 0, для нафталина - 16 5 и 16 7, для антрацена - 21 7 и 22 6 ккал / молъ. [2]
Справедливость атом-атомного подхода к расчету взаимодействия сложных молекул и предположение об аддитивности этих взаимодействий по атомам к настоящему времени достаточно надежно показана на примере вычисления свойств органических молекулярных кристаллов. Для метана теория и опыт дают 2 4 ккал / молъ, а соответствующие числа для адаман-тана - 15 5 и 12 7, для бензола - 10 5 и 10 0, для нафталина - 16 5 и 16 7, для антрацена - 21 7 и 22 6 ккал / молъ. [3]
Применение атом-атомного подхода к структурам жидкостей должно оказаться плодотворным, особенно для тех жидкостей, в которых взаимная ориентация несферических молекул играет важную роль. В работе Г. Н. Саркисова и В. Г. Дашевского [48] равновесная структура и термодинамические свойства жидкой воды были рассчитаны в атом-атомном приближении. [4]
Однако нам представляется, что последовательный атом-атомный подход к рассмотрению взаимодействия сложных систем, о которых идет речь, должен быть более универсальным и строгим. Такой подход предполагает вычисления энергии взаимодействия пары неполярных молекул как суммы энергий взаимодействия составляющих их атомов. Вид потенциальных кривых для разных сортов атомов считается независящим от того, в какую молекулу они входят, а константы в потенциальных кривых, для которых мы применяем форму ( 6, ехр), подбираются эмпирически из анализа физических свойств кристалла. [5]
Не следует, конечно, думать, что атом-атомный подход является единственным средством учета влияния растворителя. Для оценки разностей энергий конформеров малых молекул обычно применяется феноменологическая теория, основанная на реактивном поле Онзагера ( см. раздел 5 гл. Легко усмотреть аналогию в применении атом-атомного подхода к растворам и в применении уравнения Шредингера к большим органическим молекулам: и в том, и другом случае все в принципе ясно - ясно, что полный расчет должен привести к правильным предсказаниям, но вычислительные трудности столь велики, что их лишь в редких случаях удается преодолеть. [6]
Рассмотрим более подробно работы Полтева и Сухорукова [ 68 - 691, которые использовали атом-атомный подход для вычисления взаимодействий в полинуклеотидах и дали оценки осевых взаимодействий в чистом виде. Энергия взаимодействия оснований была представлена в виде суммы электростатической энергии Е, индукционной Я, энергии притяжения валентно не связанных атомов F и энергии отталкивания V. Далее, было показано, что индукционные взаимодействия малы, а электростатическая энергия рассчитывалась, в отличие от работы Де Во и Тиноко, уже в монопольном приближении. [7]
Итак, схема атом-атом потенциалов оказалась вполне приемлемой для расчетов термохимических параметров таких разных систем, как алканы, олефины, ароматические молекулы, цикло-алканы и циклоалкены, бициклические и полициклические системы и, наконец, галогенпроизводные. Насколько же оправдан такой подход к расчетам энтальпий атомизации более сложных молекул, как, например, кислородсодержащих молекул или нитро-соединений, без детального анализа сказать трудно, однако тот факт, что грубые аддитивные схемы недурно работают для таких сложных систем, позволяет надеяться и на успех схемы атом-атом потенциалов. Преимущество атом-атомного подхода очевидно - он является ключом к пониманию связи между геометрией молекул и термохимическими свойствами веществ. [8]
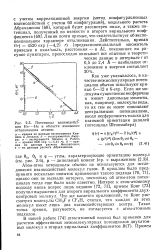 |
Потенциал взаимодейст взаимной ориентации диполей вия Не - - - Не в области взаимного ( потенциал Штокмайера отталкивания атомов. [9] |
Атом-атом потенциалы обычно не используются для исследования взаимодействий молекул газов. В прошлом было предпринято несколько попыток применения такого подхода [70, 71], однако они не вызвали интереса, поскольку об атом-атом потенциалах тогда еще было мало известно. Интерес к атом-атомному подходу вновь возрос лишь недавно [72, 73], причем Конг [73] получил выражения для второго вириального коэффициента двух-центровых молекул. Что же касается приложений, то Конг рассмотрел молекулы CH3F и CF H, считая, что каждая из этих молекул имеет лишь два взаимодействующих центра. Такая точка зрения, разумеется, не согласуется с атом-атомным подходом. [10]
Не следует, конечно, думать, что атом-атомный подход является единственным средством учета влияния растворителя. Для оценки разностей энергий конформеров малых молекул обычно применяется феноменологическая теория, основанная на реактивном поле Онзагера ( см. раздел 5 гл. Легко усмотреть аналогию в применении атом-атомного подхода к растворам и в применении уравнения Шредингера к большим органическим молекулам: и в том, и другом случае все в принципе ясно - ясно, что полный расчет должен привести к правильным предсказаниям, но вычислительные трудности столь велики, что их лишь в редких случаях удается преодолеть. [11]
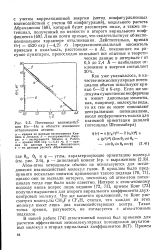 |
Потенциал взаимодейст взаимной ориентации диполей вия Не - - - Не в области взаимного ( потенциал Штокмайера отталкивания атомов. [12] |
Атом-атом потенциалы обычно не используются для исследования взаимодействий молекул газов. В прошлом было предпринято несколько попыток применения такого подхода [70, 71], однако они не вызвали интереса, поскольку об атом-атом потенциалах тогда еще было мало известно. Интерес к атом-атомному подходу вновь возрос лишь недавно [72, 73], причем Конг [73] получил выражения для второго вириального коэффициента двух-центровых молекул. Что же касается приложений, то Конг рассмотрел молекулы CH3F и CF H, считая, что каждая из этих молекул имеет лишь два взаимодействующих центра. Такая точка зрения, разумеется, не согласуется с атом-атомным подходом. [13]
Страницы: 1