Закон - реакция
Cтраница 3
Реакция замещения, протекающая по мономолекулярному механизму, также может проходить по закону реакций первого порядка при общей скорости процесса, равной скорости гетеролиза. Однако это также можно рассматривать как предельный случай, приближенно осуществляющийся, если скорость процесса, обратного гетеролизу, значительно меньше скорости координации карбоний-иона с атакующим агентом. Такое приближение часто, хотя и не всегда, достаточно верно, если замещающий агент присутствует в значительном избытке, например если он представляет собой один из основных ингредиентов растворителя. [31]
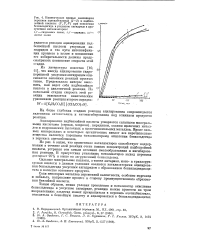 |
Кинетические кривые накопления перекиси ацетилбензоила ( 1 - 3 и надбен-зойной кислоты ( Г, 2, 3 при окислении бензальдегида в уксусном ангидриде в присутствии катализаторов. [32] |
Из литературы известно [10, 11], что иногда ацилирование гидроперекисей уксусным ангидридом описывается законами реакций простых типов. Представляло интерес выяснить, как ведет себя надбензойная кислота в аналогичной реакции. [33]
Проведена кинетическая обработка полученных результатов; определено, что скорость разложения гидроперекиси подчиняется закону реакции 11-го порядка. Определены константы скорости и энергия активации этой реакции. Исследованы состав кислот, образующихся при термическом распаде гидроперекиси, н процесс разложения гидроперекиси в присутствии водной щелочи на лабораторной н опытной установках. [34]
Эта реакция представляет собою бимолекулярную реакцию замещения ( Sjv2), зависящую по закону реакций второго порядка от концентрации обоих реагирующих веществ. [35]
 |
Блок-схема установки. [36] |
Из уравнения ( 4) видно, что, если концентрация убывает по закону реакции первого порядка, между потенциалом индикаторного электрода и временем должна наблюдаться линейная зависимость, угловой коэффициент которой определяется константой скорости. [37]
Определить период половины превращения кислоты при 30 С, если разложение ее протекает по закону реакций первого порядка. [38]
Как известно, процессы окисления органических соединений в жидкой фазе многостадийны и развиваются по законам цепных разветвленных и вырожденных реакций. Вследствие этого в углеводородной среде может присутствовать значительное количество кислородных соединений - продуктов последовательных превращений, начиная от первичных структур молекулярного веса, близкого к окисляющимся соединениям, и до конечных структур, не изменяющихся в данных условиях. [39]
Как известно, процессы окисления органических соединений в жидкой фазе многостадийны и развиваются по законам цепных разветвленных и вырожденных реакций. [40]
Уравнение ( 15) показывает, что растворение твердых веществ в указанных условиях должно пойти по закону реакции, первого порядка. [41]
При проведении реакции в присутствии большого избытка гидроксиламипа концентрация последнего практически постоянна и реакция протекает по закону реакции первого порядка. Карвон и продукт его превращения оксим имеют асимметрический атом углерода и, следовательно, оптически активны, причем их удельное вращение различно. Поэтому за ходом реакции можно следить по изменению угла а вращения плоскости поляризации света раствором, в котором происходит реакция. [42]
При проведении реакции в присутствии большого избытка гидро-ксиламина его концентрация практически постоянна и реакция протекает по закону реакции первого порядка. [43]
 |
Изменение угла вращения ПОрЦИОНЗЛЬНО ИХ концентрации, ТО плоскости поляризации света раство - применима формула, КОТО-ром rf - карвона в ходе его превраще - рая в рассматриваемом случае. [44] |
При проведении реакции в присутствии большого избытка гидро-ксиламина концентрация последнего практически постоянна и реакция протекает по закону реакции первого порядка. Карвон и продукт его превращения - оксим имеют асимметрический атом углерода ( в формулах соединений он отмечен звездочкой) и, следовательно, оптически активны, причем их удельное вращение различно. Поэтому за ходом реакции можно следить по изменению угла а вращения плоскости поляризации света раствором, в котором происходит реакция. [45]
Страницы: 1 2 3 4