Закон - скорость - первый порядок
Cтраница 1
Закон скоростей первого порядка совместим с механизмом замещения при карбоний-ионе, так как в первой стадии процесса, определяющей скорость реакции, нуклеофильный реагент не участвует. Механизм двухстадий-ных реакций получил название SN1, что означает мономолекулярное нук-леофилъное замещение. [1]
Закон скоростей первого порядка совместим с механизмом замещения при карбоний-ионе, так как в первой стадии процесса, определяющей скорость реакции, нуклеофильный реагент не участвует. Механизм двухстадий-ных реакций получил название SNl, что означает мономолекулярное нук-леофилъное замещение. [2]
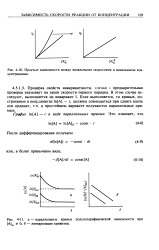 |
Простые зависимости между начальными скоростями и начальными концентрациями. [3] |
СЛУЧАЙ i: предварительная проверка указывает на закон скорости первого порядка. В этом случае исследуют, выполняется ли инвариант I. Если выполняется, то кривые, построенные в координатах 1п [ А ] - t, должны совмещаться при сдвиге вдоль оси ординат, т.е. в простейшем варианте получаются параллельные прямые. [4]
Таким образом, в самой простой системе, где ожидалось выполнение закона скорости первого порядка, найдено, что скорость реакции имеет довольно сложную зависимость как от концентрации, так и от общего состава. [5]
В данном разделе, суммирующем эмпирические наблюдения химической кинетики, показано, что ряд газовых реакций следует закону скорости первого порядка. Закоп скорости второго порядка часто может быть сведен к процессу бимолекулярных столкновений, но как объяснить первый порядок реакции в газовой фазе. Трудность состоит в том, что нужно объяснить кинетику первого порядка, несмотря на то что молекула, вероятно, приобретает энергию, необходимую для изменения ее формы, при столкновении с другими молекулами. Нужно найти схему реакции, которая приводит к форме &i [ A ], но которая при этом включает бимолекулярные процессы, необходимые для накопления в молекуле достаточной энергии. [6]
В данном разделе, суммирующем эмпирические наблюдения химической кинетики, показано, что ряд газовых реакций следует закону скорости первого порядка. Закон скорости второго порядка часто может быть сведен к процессу бимолекулярных столкновений, но как объяснить первый порядок реакции в газовой фазе. Трудность состоит в том, что нужно объяснить кинетику первого порядка, несмотря на то что молекула, вероятно, приобретает энергию, необходимую для изменения ее формы, при столкновении с другими молекулами. Нужно найти схему реакции, которая приводит к форме &i [ A ], но которая при этом включает бимолекулярные процессы, необходимые для накопления в молекуле достаточной энергии. [7]
 |
Кривые зависимости концентрации от времени для двух параллельных реакций первого порядка. [8] |
Суть рассмотренного случая состоит в том, что как расходование реагента, так и образование продукта подчиняются закону скорости первого порядка. Поэтому все методы, описанные для последнего, применимы и здесь для получения в любой момент времени суммы констант скоростей двух стадий. [9]
Как правило, скорость сольволитических реакций третичных галогени-дов не возрастает при введении сильных нуклеофилов. Например, скорость гидролиза хлористого пгрето-бутила не увеличивается при добавлении едкого натра, несмотря на то что в процессе данной реакции поглощаются гпдро-ксильные ионы. Поскольку скорость этой реакции зависит исключительно от концентрации одного реагента, а именно галогенида, скорость определяется законом скоростей первого порядка. [10]
Как правило, скорость сольволитических реакций третичных галогени-дов не возрастает при введении сильных нуклеофилов. Например, скорость гидролиза хлористого трет-бутила не увеличивается при добавлении едкого натра, несмотря на то что в процессе данной реакции поглощаются гидро-ксильные ионы. Поскольку скорость этой реакции зависит исключительно от концентрации одного реагента, а именно галогенида, скорость определяется законом скоростей первого порядка. [11]
Страницы: 1