Закон - сохранение - масса
Cтраница 2
Закон сохранения массы при химических реакциях был открыт и экспериментально доказан Ломоносовым и затем подтвержден Лавуазье. Что же касается закона сохранения энергии, то точная формулировка его была дана лишь в XIX в. [16]
 |
Современные весы для особо точных взвешиваний. [17] |
Закон сохранения массы используется в химии для контроля количественных анализов веществ. [18]
Закон сохранения массы используется также для определения веса участвующих в реакции веществ, непосредственно не доступных исследованию. Впервые с той же целью закон сохранения массы был применен Кавен-дишем при определении удельного веса водорода и химических эквивалентов металлов ( см. стр. [19]
Закон сохранения массы утверждает, что масса материального объема (2.1) остается постоянной. [20]
Закон сохранения массы, не связанный, как видно из приведенных выводов, с представлением об идеальности жидкости, справедлив и в случае неидеальной жидкости. [21]
Закон сохранения массы, согласно ( 32) гл. [22]
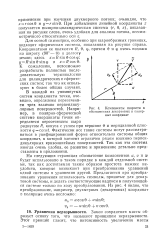 |
Компоненты скорости. [23] |
Закон сохранения массы образует основу того, что называют принципом неразрывности. [24]
Закон сохранения массы при химических реакциях и физические воззрения Ломоносова. [25]
Закон сохранения массы служит основой при изучении реакций между различными веществами. [26]
Закон сохранения массы и закон сохранения энергии представляют собой наиболее общие законы физики, распространяющиеся на все физические явления. Эти законы являются основными и в аэродинамике. [27]
Закон сохранения массы принимает в этом случае форму закона сохранения объема. Отсюда происходит название уравнение неразрывности движения, которое обычно без изменений распространяют и на общий случай сжимаемой жидкости. [28]
Закон сохранения массы, многократно проверенный ео времени его открытия Ломоносовым и Лавуазье, утверждает, что сумма масс веществ, вступающих в химическую реакцию, равна сумме масс веществ, получаемых в результате реакции. Однако при химических реакциях поглощается либо выделяется энергия и в соответствии с установленным в теории относительности соотношением должно быть отличие в суммах масс веществ, вступающих в химическую реакцию и получаемых в результате реакции. При сгорании угля это отличие составляет примерно 1 г на 3000 т угля. Для того чтобы количественно оценить такое ничтожно малое отличие, необходимо произвести взвешивание с точностью до трех стомиллионных долей процента. [29]
 |
Весы Ломоносова для малых навесок. [30] |
Страницы: 1 2 3 4