Закон - гульдберг
Cтраница 1
Закон Гульдберга и Вааге на первых порах применялся, главным образом, при изучении химических равновесий ( химическая статика) и практически не использовался при изучении скоростей реакций. [1]
По закону Гульдберга и Вааге скорость прямой реакции в любо. [2]
Кинетика реакции образования гидроокиси алюминия описывается законом Гульдберга - Вааге 1154 ], а кинетическая константа определяется по формуле Аррениуса. [3]
Кинетика реакции образования гидроокиси алюминия описывается законом Гульдберга - Вааге [154], а кинетическая константа определяется по формуле Аррениуса. [4]
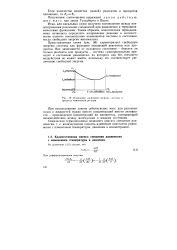 |
Изменение свободной энергии системы в процессе химической реакции. [5] |
Полученные соотношения выражают закон действующих масс или закон Гульдберга и Вааге. [6]
Соотношения ( 1) и ( 2) выражают закон действующих масс, или закон Гульдберга и Вааге. [7]
Наконец, адсорбционная фаза рассматривается как двумерный газ, и ко всякому элементарному процессу применяется, как в газовой фазе закон Гульдберга и Вааге; при этом достаточно лишь заменить объемные концентрации-на поверхностные. [8]
Среди видя исследователей в этой области крупные заслуги принадлея профессору в Ростоке ( ГДР) Гансу Фалькенгагену ( 1895 - 197 По закону Гульдберга и Вааге действующие массы веще определяются равновесными концентрациями. Однако в i мои начале текущего столетия было выяснено, что гомогенн равновесия в растворах электролитов не подчиняются это закону. Льюис показал, что закон действующ масс применим только к идеальным газам и идеальным расп рам. О функции связаны друг с другом. [9]
В некоторых работах по истории химии говорится, что учение Бертолле о сродстве возродилось во второй половине XIX в. Однако едва ли можно признать, что закон Гульдберга и Вааге ( 1867 г.) представляет собой возрождение идеи Бертолле. Его искусственно построенная система, основанная на картезианском принципе бесконечной делимости материи, не имела под собой никакой почвы, не была подтверждена ни одним экспериментальным ( достоверным) фактом и поэтому была отброшена химиками. [10]
Химические реакции между молекулами протекают с различными скоростями. Зависимость их от концентрации реагирующих веществ определяется законом Гульдберга и Вааге. [11]
Как известно, на основе представления о химическом равновесии как о равновесии динамическом можно получить выражение для, закона действующих масс, приравнивая скорости прямой и обратной реакций в состоянии равновесия. В случае сложных реакций выражения для этих скоростей могут весьма отличаться от простого выражения, которое получается путем применения закона Гульдберга и Вааге к суммарной реакции. [12]
Состояние химического равновесия характеризуется рядом важных особенностей. Состояние равновесия, как следует из закона Гульдберга и Вааге, имеет динамический характер, так как связано с равенством скоростей прямой и обратной реакций. [13]
Далее он показал, каким образом законы газов могут быть, по-видимому, применены к разбавленным растворам. Отсюда, если закон Авогадро применить к разбавленным растворам, должны получиться некоторые следствия, как закон Гульдберга - Вааге. Затем он показал, что эти следствия действительно получаются. Далее, он обратил внимание слушателей на ту часть теории, которая наиболее интересует Вас, а именно электролитическую диссоциацию, как теорию, объясняющую аномальные на вид результаты. [14]
Страницы: 1