Закон - действие
Cтраница 1
Закон действия этих сил неизвестен, хотя многие характерные их свойства хорошо изучены экспериментально. Эти силы действуют лишь на малых расстояниях порядка 10 - 15 м ( это порядок размера ядер) и являются короткодействующими. На более далеких расстояниях они практически обращаются в нуль. На расстояниях же, меньших 10 15 м, они примерно в сто раз больше, чем электромагнитные. Именно благодаря этому силы электрического отталкивания между протонами в ядрах не в состоянии преодолеть силы ядерного притяжения между ними. [1]
Закон действия масс. Чтобы атомы или молекулы смогли вступить в реакцию, необходимо их столкновение друг с другом - силы химического взаимодействия действуют только на очень малом расстоянии. Очевидно, скорость реакции должна быть прямо пропорциональна числу таких столкновений. Но в свою очередь это число прямо пропорционально количеству молекул вещества в единице объема реагирующей смеси, или, иначе, его концентрации. [2]
Закон действия масс. Скорость реакции в каждый момент пропорциональна произведению концентраций реагирующих веществ к этому моменту. [3]
Закон действия масс. Основным законом химической кинетики является открытый в 1864 - 1867 гг. Гульдбергом и Вааге ( Норвегия) закон действия масс, согласно которому скорость элементарной реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Такая зависимость скорости реакции от концентрации обусловлена тем, что вероятность столкновения молекул и, следовательно, их взаимодействия, пропорциональна произведению концентраций реагентов. [4]
Закон действия масс. Одним из основных параметров химических процессов, осуществляемых в промышленности, является скорость, с которой эти процессы протекают. Иногда способ химической переработки сырья может быть простым, однако время, необходимое для получения продукта, оказывается весьма значительным. [5]
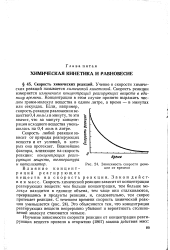 |
Зависимость скорости реакции от времени. [6] |
Закон действия масс. Скорость химической реакции зависит от концентрации реагирующих веществ: чем больше концентрация, тем больше молекул находится в единице объема, тем чаще они сталкиваются, превращаясь в продукты реакции, и, следовательно, тем скорее протекает реакция. Это объясняется тем, что концентрации реагирующих веществ непрерывно убывают и вероятность столкновений молекул становится меньше. [7]
Закон действия масс. Основным законом химической кинетики является открытый в 1864 - 1867 гг. Гульдбергом и Вааге ( Норвегия) закон действия масс ( закон действующих масс), согласно которому скорость элементарной реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Такая зависимость скорости реакции от концентрации обусловлена тем, что вероятность столкновения молекул и, следовательно, вероятность их взаимодействия, пропорциональна концентрациям реагентов. [8]
Закон действия масс. Зависимость между скоростью химических реакций и концентрациями реагирующих веществ определяется законом действия масс. f Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. [9]
Закон действия масс. Связь между равновесными концентрациями или парциальными давлениями веществ, участвующих в химической реакции, выражает закон действия масс. Этот закон выводится согласно уравнению (2.82), если химический потенциал выразить как функцию концентраций или парциальных давлений. [10]
Закон действия ( действующих) масс. Закон действия масс ( 1867, Гульдберг и Вааге), лежащий в основе учения о химическом равновесии, опроверг обе эти концепции, позволил правильно подойти к освещению проблем как химического сродства, так и связи направления реакции с величиной и знаком термодинамических функций. [11]
Закон действия - масс помогает найти условия, при которых из раствора будет выкристаллизовываться карналлит. [12]
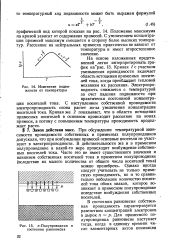 |
Изменение подвижности от температуры. [13] |
Закон действия масс. При обсуждении температурной зависимости проводимости собственных и примесных полупроводников допускали, что при возбуждении примесей основные носители не участвуют в электропроводности. В действительности же и в примесном полупроводнике в какой-то мере происходит возбуждение собственных носителей тока. [14]
Закон действия масс. Основным законом химической кинетики является открытый в 1864 - 1867 гг. Гульдбергом и Вааге ( Норвегия) закон действия масс ( закон действующих масс), согласно которому скорость элементарной реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Такая зависимость скорости реакции от концентрации обусловлена тем, что вероятность столкновения молекул и, следовательно, вероятность их взаимодействия, пропорциональна концентрациям реагентов. [15]
Страницы: 1 2 3 4