Линейный закон - рост
Cтраница 2
 |
Кривые роста фазы I в покрытии. [16] |
Практическое осуществление параболического роста встречает ряд затруднений. Наиболее просто может быть осуществлен линейный закон роста толщины покрытия. Он наблюдается во всех процессах, связанных с конденсацией материалов при умеренных температурах. На рис. 49 для сравнения приведены различные законы роста толщины покрытий. [17]
Такая зависимость часто наблюдается на практике при малой толщине слоя продукта реакции, поэтому ее называют линейным законом роста твердой фазы. Коэффициент пропорциональности Ki называется константой линейного закона роста фаз. [18]
При наличии алюминия в покрытии появляются линии MoSi2 гексагональной модификации. Интересным фактом является обнаруженный авторами [58] линейный закон роста толщины слоя гексагонального MoSi2 от времени. Авторы [58] полагают, что он обусловлен линейным изменением концентрации кремния на поверхности образца, что связано с различием упругости паров алюминия и кремния и повышением концентрации последнего в процессе вакуумного насыщения. [19]
Рост пористой пленки происходит по следующим взаимосвязанным стадиям: перенос окислителя к поверхности металла, его адсорбция и химическая реакция образования оксида. Для таких пористых ( незащищенных) пленок характерен линейный закон роста, поскольку скорость роста пленки контролируется скоростью реакции окисления металла и выражается зависимостью: hkiT, где h - толщина пленки; k - константа химической реакции; т - время. [20]
 |
Кинетика газово коррозии при линейном ( /, параболическом ( 2 и логарифмическом ( 3 законах окисления. [21] |
Если пленка очень тонкая ( л - - 0), то первый член уравнения значительно меньше второго. Поэтому, пренебрегая первым членом уравнения, мы приходим к линейному закону роста пленки. Если же толщина пленки велика, то, пренебрегая вторым членом уравнения, мы приходим к параболическому закону роста пленки. [22]
При образовании однофазных покрытий из карбида ниобия состава NbC наблюдаются следующие закономерности. С повышением температуры поверхностная концентрация углерода в покрытиях увеличивается при линейном законе роста. [23]
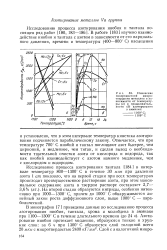 |
Изменение поверхностной микротвердости металлов в зависимости от температуры ( а и продолжительности ( б азотирования в аммиаке. [24] |
Исследование процесса азотирования тантала [184] в интервале температур 800 - 1300е С в течение 30 мин при давлении азота 1 am показало, что на первой стадии при всех температурах происходит преимущественное растворение азота, при этом максимальное содержание азота в твердом растворе составляет 2 7 - 3 6 % ( ат. На второй стадии образуются нитриды, особенно интенсивно при 1000 - 1300е С, причем до 1000 С обнаруживается линейный закон роста диффузионного слоя, выше 1000 С - параболический. [25]
 |
Температурная зависимость скорости. [26] |
Уран реагирует с водой с образованием двуокиси урана, водорода и гидрида урана. Существование гидрида, однако, весьма эфемерно - он сам взаимодействует с водой, в результате чего также возникают двуокись урана и водород. Окисел формируется в основном в виде не обладающего адгезией к поверхности металла порошка, и при этом наблюдается линейный закон роста. В частности, присутствие кислорода в значительной степени уменьшает скорость реакции [2], но в то же время делает металл склонным к щелевой и питтинговой коррозии. Ингибирующее действие кислорода наиболее заметно при низких температурах, когда его растворимость в воде максимальна, а выделяющегося водорода недостаточно для локального восстановления растворенного кислорода. Механизм воздействия кислорода может быть связан с преимущественной адсорбцией его на окисле [3] или с прекращением реакции образования нитрида, оказывающей разрушающее влияние на поверхность металла. Согласно другой точке зрения на природу таких водородных эффектов, основанной на результатах измерения импеданса в процессе коррозии [4], они связаны с изменением электрических свойств окисла под действием водорода. [27]
Как показывает анализ, при увеличении переохлаждения происходит изменение механизма затвердевания. Диффузионно-лимитируемый рост кристаллов сменяется на термически контролируемый режим роста. Это сопровождается резким увеличением скорости роста вершин дендритов и началом бездиффузионного затвердевания дендритных стволов. Переход к бездиффузионному затвердеванию и росту термических дендритов в сплаве осуществляется при достижении критического переохлаждения и скорости VD диффузии в расплаве На рисунке показаны кинетические кривые скорость-переохлаждение для вершин растущих дендритов в сплавах Ni - 0.7 ат. Видно, что при VVD происходит переход от степенного закона роста к линейному закону роста дендритов Этот переход в кинетике связан с окончанием диффузионно-лимитируемого роста и началом термически контролируемого роста. [28]
Более того, даже в условиях образования компактного слоя продукта твердофазной реакции принятые выше предположения могут не отвечать реальным ситуациям. Однако при достаточно высокой скорости процесса это условие может не выполняться. Частицы, переходящие в соседнюю фазу, скорее всего сосредоточены на некоторых активных центрах, концентрация которых может быть значительно ниже общей концентрации поверхностных узлов. Поэтому при достаточно высокой скорости реакции вполне правдоподобна ситуация, при которой активные позиции обеднены участвующими в реакции атомами. Соответствующее третье уравнение системы может быть сформулировано только на основе определенных модельных представлений о переходе атомов А, В или ионов Мгм из их решеточного состояния в активное состояние, из которого они переходят в фазу продукта реакции. Это приведет к тому, что все переменные Ац окажутся зависящими от времени и согласно уравнениям (7.94) и (7.116) величина Ki окажется также зависящей от времени. Следовательно, при этих условиях линейный закон роста продукта реакции будет нарушен, и тем в большей степени, чем больше химические потенциалы исходных реагентов в их активном состоянии на границе с продуктом реакции отличаются от их значений в объеме соответствующей фазы. [29]
Страницы: 1 2