Полинг
Cтраница 3
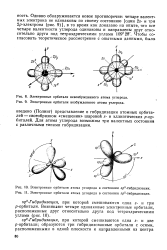
Полинг) представление о гибридизации атомных орбита-лей - своеобразном смешении шаровой s - и эллиптических р-ор-биталей. Для атома углерода возможны три валентных состояния с различными типами гибридизации. [32]
Полинг показал, что каждый ковалентно связанный атом занимает определенный объем, в первом приближении не зависящий от природы второго партнера. Поэтому длины ковалентных связей могут быть представлены как суммы ковалентных радиусов связанных атомов. [33]
Полинг [44] считает, что в случае двухвалентной серы связывающие электронные орбитали являются - электронными, а два неспаренных электрона являются 3s - и Зр2 - электронами. [34]
 |
Схематическое изображение уровней и энергетических зон в атоме натрия и кристалле металлического натрия ( по Полингу. [35] |
Полинг предположил, что связи в металлической кристаллической решетке находятся в резонансе и валентные электроны в кристалле распределены статистически ( равномерно) между всеми соседними атомами. Согласно теории Полинга, между атомами металлов устанавливаются двухэлектронные связи, которые непрерывно разрываются и восстанавливаются между различными парами соседних атомов в решетке. В образовании металлических связей в кристаллическом натрии принимает участие один валентный электрон от каждого атома. [36]
 |
Дипольные моменты некоторых соединений. [37] |
Полинг полагает, что разность А тем больше, чем больше отклонение связи А - В от неполярной ковалентной связи. [38]
Полинг рассчитал относительную электроотрицательность ( ЭО) для элементов периодической системы, подобрав численные постоянные составленных им уравнений так, что значения ЭО оказались в интервале удобных чисел; они принимают значения от 0 7 для франция до 4 0 для фтора. Из направления кривых видно, что в каждом периоде периодической системы относительные электроотрицательности возрастают слева направо, а в каждой группе - снизу вверх. [39]
Полинг [11] первый представил его в формулировках, доступных даже непосвященным ( см. [3] стр. [40]
Полинг предложил еще один очень полезный метод, который позволяет до некоторой степени количественно выразить полярность связей между атомами независимо от приближенных квантовохимических методов, которые не всегда достаточно понятны. Полярную связь можно представить в виде простой мезомерной системы из трех валентных структур А - В, [ А: - ] [ В ], [ А ] [ В: ]; причем всегда имеет значение только одна из двух ионных валентных структур. По Полингу, энергию преимущественно ковалентной связи А-В можно достаточно хорошо оценить как среднее арифметическое или среднее геометрическое из наблюдаемых энергий связей А-А и В-В. Если теплоты образования А-А и В-В не сильно различаются, применяют среднее арифметическое, в противном случае используют среднее геометрическое. [41]
Полинг в начале 30 - х годов развил этот метод применительно к комплексообразованию. [42]
Полинг [52] объясняет это наблюдение следующим образом. [43]
Полинг предложил эмпирическую качественную схему для обсуждения дополнительной стабильности, которую придает связям резонанс с ионными структурами. [44]
Полинг [7] постулировал, что если лиганд обладает или может обладать благодаря резонансу вакантными орбиталями и если центральный атом имеет d - электроны, то будут образовываться л-связи, направленные с металла на лиганд. Это способствует упрочению координационной связи ( делая ее двойной) и уменьшает отрицательный заряд, созданный на центральном атоме лпгандами. Наоборот, если лиганд имеет дополнительные неподеленные пары электронов, а атом металла имеет подходящие вакантные орбитали, то может образоваться л-свнзь в направлении с лиганда на металл. [45]
Страницы: 1 2 3 4