Политерма - система
Cтраница 1
Политерма системы КС1 - MgCl2 - H20 является основой, на которой базируется ряд технических способов разложения карналлита: полное разложение, неполное, смешанное, разложение конечным щелоком, способ на конечный щелок и другие способы. [1]
Политерма системы КС1 - MgCl2 - H20 является основой, на которой базируется ряд технических способов разложения карналлита: полное разложение, неполное, смешанное, разложение конечным щелоком, способ на конечный щелок и другие способы. [2]
Политерма системы прослежена в интервале температур от полного замерзания до 65 в связи с поставленной задачей изучения области низкотемпературных составов. [3]
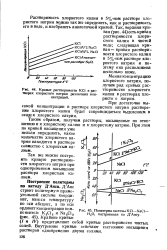 |
Кривые растворимости КС1 в растворах хлористого натрия различных концентраций. [4] |
Политерма системы КС1 - NaCl - H2O, построенная по Д Ансу. [5]
 |
Растворимость дитионита натрия в воде. [6] |
На основании политермы системы установлено, что в изученном интервале температур ( см. табл. 19) хлорид натрия выпадает в твердую фазу в виде безводной соли; при температурах ниже 32 С дитионит натрия выпадает в виде дигидрата, выше 32 С твердая фаза системы содержит двуводный и безводный дитионит натрия. При дальнейшем повышении температуры поле двуводной соли уменьшается и при 62 С оно исчезает полностью. [7]
Треугольную призму, отображающую политерму системы, можно представить себе как бесконечное множество плоских политерм, положенных друг на друга. По этой причине все точки, показанные на комбинации изотермических проекций на прямую Н2О ( 3) - Н2О ( /) ( рис. 77), на политермической проекции будут представлены в виде бесконечного множества точек, образуя линии, на которых мы увидим безвариантные точки. Последние, как уже было указано, отвечают в двойных системах растворам, насыщенным относительно двух твердых фаз, а в тройных - относительно трех твердых фаз. [8]
На рис. 39 приведена политерма системы КС1 - NaCl - Н20 в интервале температур от 10 до 100, построенная в прямоугольных координатах. [9]
На рис. 3 представлена политерма системы NH4H2P04 - NH4N03 - Н О от точки замерзания до 130 С. Данные Бергмана и Свешникова несколько расходятся с данными Шродта. [10]
На рис. 39 приведена политерма системы KCI-NaCl - Н20 в интервале температур от 10 до 100, построенная в прямоугольных координатах. [11]
На рис. 5 - 14 представлена политерма системы в простейшем случае, когда между компонентами системы не происходит химического взаимодействия. Соединяя узловые точки изотерм, строят политермическую диаграмму. Таким образом строится политерма четырехкомпонентной системы ( рис. 5 - 14); для наглядности представлений о виде политермической диаграммы даны изотермические сечения и выделены объемы существования солей В и С и D в избранном интервале температур. [12]
Эта диаграмма представляет собой горизонтальную проекцию политермы системы NaCl NH4HC03 NaHC03 NH4C1, построенную по Левенгерцу. [13]
Поля кристаллизации твердых фаз и характер участка политермы системы видны на рис. 3, где нанесены изотермы при 20 и 40 в треугольной диаграмме. [14]
Мы уже говорили о том, что геометрическим образом политермы системы из четырех компонентов при фиксированном давлении является четырехмерная, а изотермы - трехмерная фигура. [15]
Страницы: 1 2