Полихроматы
Cтраница 1
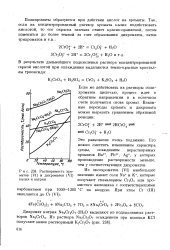 |
Растворимость хро-матов ( VI и дихроматов ( VI калия и натрия. [1] |
Полихроматы образуются при действии кислот на хроматы. [2]
Полихроматы образуются при действии кислоты на хро-маты. [3]
 |
Система Tl2SO4 - H2SO4 f - H2O при 25. [4] |
Полихроматы таллия не образуются. [5]
Какие полихроматы легче, получаются - натрия или аммония. [6]
Именно по этой причине дихроматы и полихроматы, устойчивые в кислотной среде, являются более энергичными окислителями. [7]
При подкислении водных растворов хроматов образуются би-хроматы, в концентрированных растворах - полихроматы. [8]
При подкислении водных растворов хроматов образуются дихроматы, в концентрированных растворах - полихроматы. [9]
При подкислешш водных растворов хроматов образуются бихроматы, а в случае концентрированных растворов - три -, тетра - или полихроматы. [10]
При подкислении водных растворов хроматов образуются дихроматы, при дальнейшем усилении кислотности раствора и концентрации хрома ( VI) получаются трихроматьг ( МгСгзОю), тетрахроматы ( M2Cr4Oi3) и другие полихроматы. [11]
В таких единениях не имеется непарных электронов. Полихроматы порывают примерно такие же значения. [12]
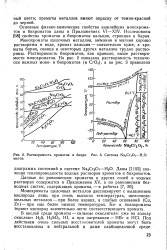 |
Растворимость хроматов и бихро - [ IMAGE ] Система Na2Cr2O7 - HiO. матов. [13] |
Монохроматы щелочных металлов диссоциируют с выделением кислорода лишь при очень высоких температурах, щелочноземельных металлов - при более низких, а слабых оснований ( Си, Zn) - при еще более низких температурах. Би - и полихроматы теряют кислород значительно легче соответствующего хромата. [14]
Для полирования хрома f87 ] предложены фосфорнокислые электролиты с добавками глицерина или лимолной кислоты. Если в электролит добавлять полихроматы, то полированная поверхность хрома может быть окрашена. [15]
Страницы: 1 2