Координационный полиэдр - атом - металл
Cтраница 1
Координационный полиэдр атома металла образован пятью группами NH3 и атомом азота группировки N2, соединяющей два октаэдра в димер. [1]
 |
Кристаллическая структура. [2] |
Структуры оксидов MosOu, Moi7O47 и Wis049 относятся к иному типу; в них координационные полиэдры атомов металла - октаэдры и пентагональные биппрамиды ( разд. [3]
Для рассмотренных комплексов 12 -, 13 - и 14-членных тетра-минных макроциклов с насыщенными металлоциклами возможны три типа конформации: 1) атомы азота копланарны; 2) атомы азота некопланарны и макроцикл имеет складчатую конфор-мацию, в которой одноименные металлоциклы располагаются попарно в двух взаимно перпендикулярных плоскостях; диагональ макроцикла приближается к линейной с увеличением числа членов цикла; 3) конформация макроцикла также складчатая, но угол между плоскостями, в которых расположены металлоциклы, значительно больше 90 и может достигать 135 в зависимости от координационного полиэдра атома металла. [4]
Восемь соединений, рассматриваемых в таблице 12, дают десять примеров комплексов с полукластерными ядрами. В шести случаях координационный полиэдр атома металла имеет форму искаженного октаэдра, в одном - тригональной бипи-рамиды, в двух структурах, содержащих комплексы S2Fe2 ( CO) 6, полиэдр можно рассматривать и как октаэдр, и как тригональ-ную бипирамиду ( в зависимости от трактовки связей группы S2), и в одной атомы Fe координируются по типу фортепианной табуретки. [5]
 |
Геометрические характеристики молекул ряда ( я - С5Н5 М ( СО31. [6] |
Та проекция молекулы ( л - С5Н5) М ( СО) зК на плоскость циклопентадиенильного кольца. Эти параметры указывают на близость координационных полиэдров атома металла в данной группе комплексов. Следует также отметить, что взаимная ориентация лигандов вокруг атома М во всех молекулах, за исключением ( л - С. [7]
 |
Идеализированная структура оливина ( Mg2SiO4. Отмечены только те атомы Si, которые находятся между обоими слоями из атомов О. [8] |
Группа [ Si2O7 ] имеет на периферии шесть атомов О, которые одновременно могут принадлежать координационным полиэдрам соседних атомов металла. При этом атомы О групп [ Si2O7 ] одновременно входят в координационные полиэдры атомов металлов. [9]
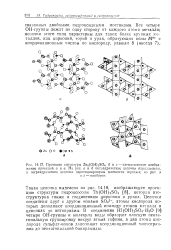
Такая цепочка выделена на рис. 14.18, изображающем проекцию структуры гидроксосоли Th ( OH) 2S04 [8], которая изо-структурна также и соединениям циркония и урана. Цепочки соединены друг с другом ионами S042 -, атомы кислорода которых дополняют координационный полиэдр атомов металла в цепочках до антипризмы. В соединении Hi ( OH) 2S04 - H2O [ 9j четыре ОН-группы и молекула воды образуют плоскую пента-гональную группировку вокруг атома гафния, а два атома кислорода сульфат-ионов дополняют координационный многогранник до пентагональной бипирамиды. [11]
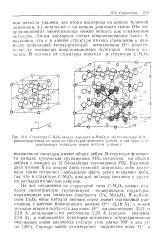 |
Структура С - М2О3 оксида марганца а - Мп2Оз п других оксидов М О демонстрирующая их связь со структурой флюорита ( слева, и два типа координационных полиэдров ионов металла ( справа. [12] |
Атомы кислорода имеют координационное число 4; возможно, что и в данной структуре именно стремление к наиболее правильной тетраэдрпческой координации О2 ответственно за искажения координационных полиэдров атомов металла. [13]
Среди соединений со связями между атомом кобальта и атомом непереходного элемента группы IVB, изучены [237, 238] молекулы тетракарбонил-кобальт-трихлорсилана ( ОС) 4 - CoSiCis ( i) и силил-кобальт-тетракарбонил H3SiCo ( CO) 4 ( II), связи Со-Si длиной 2 254 и 2 381 А в которых на - 0 28 и 0 15 А короче суммы односвязных ковалентных радиусов, а замена атома Н на атом С1 ведет к существенному ( 0 13 А) сокращению связи Со-Si. Координация атома Со искаженная триго-нально-бипирамидальная: экваториальные Co-группы отогнуты от аксиальной в сторону атома Si ( средний угол Si-Со - СЭКв. I и II соответственно), в соответствии с чем атом Со выходит из экваториальной плоскости в сторону аксиальной СО-группы. Искажение тетраэдрической координации атома Si в I происходит, как обычно, в сторону увеличения углов, образованных тройкой наиболее тяжелых атомов ( средний угол Со-Si - Cl 113 3), и уменьшения углов, включающих легкие атомы ( средний угол С1 - Si-Cl 105 4), по сравнению с идеальным. Авторы [237] отмечают, что немаловажную роль в искажении координационных полиэдров атомов металла играют стеричаские факторы: отталкивание валентно не связанных атомов влечет за собой существенные искажения валентных углов при атомах металла. [14]
Страницы: 1