Положение - бор
Cтраница 1
Положение бора и алюминия в периодической системе Д. И. Менделеева и характеристика их свойств з зависимости от электронной структуры атома. [1]
Указать положение бора в периодической системе Менделеева, строение и размеры его атома и проявляемые им валентности. [2]
Как видно, законы механики и положения Бора, отражающие поведение электрона в атоме, совместить невозможно. Кроме того, атом, построенный подобно планетной системе, не мог бы существовать и миллионной доли секунды. Дело в том, что движение по замкнутой орбите есть движение с ускорением, а всякое тело, несущее заряд, двигаясь с ускорением, непременно должно излучать энергию в виде электромагнитных волн. [3]
Весьма возможно, что заметное изменение показателя преломления бор-п алюминийсодержащих стекол при отжиге связано в известной мере с перестройкой координационного положения бора и алюминия, однако этот вопрос требует специального рассмотрения. [4]
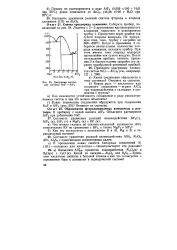 |
Диаграмма состоя ния системы NaF - AlFs. [5] |
Какой из оксидов - А12О8 или В2О3 - проявляет кислотные свойства в большей степени и как это согласуется с положением бора и алюминия в периодической системе. [6]
В настоящее время имеется достаточно фактов, подтверждающих аномальное изменение показателя преломления и некоторых других свойств щелочных боратных и боросиликатных стекол, которое лучше всего объясняется изменением координационного положения бора. Для перехода [ В03 ] в [ В04 ] требуются дополнительные свободные кислородные ионы, вносимые окислами металлов, которые сами не являются стекло-образователями. [7]
 |
Характеристики излучений ( v и в инфракрасной части спектра водорода. [8] |
Если атом водорода построен так, как это представляет себе Бор, и если второе положение Бора правильно, то спектр водорода должен состоять из ряда серий. [9]
Из сравнения рядов летучести для элементов и окислов видно, что порядок расположения элементов в обоих рядах приблизительно одинаков. Это связано отчасти с диссоциацией многих окислов, восстанавливаемых углеродом при высокой температуре. Положение бора в конце ряда также объясняется способностью его окисла восстанавливаться углеродом с образованием карбида. Такие элементы, как уран, торий, цирконий, ниобий, имеют тугоплавкие и малолетучие окислы, разложение которых идет с трудом и также сопровождается образованием малолетучих карбидов. Положение Мо и W в ряду летучести окислов определяется тем, что высшие окислы Мо и W обладают сравнительно большой летучестью, но неустойчивы при высоких температурах в дуге и переходят в малолетучие низшие окислы или восстанавливаются до металлов, имеющих высокие температуры кипения и склонных к образованию карбидов. [10]
 |
Схема опыта Розерфорда по расщеплению атома азота. [11] |
При возвращении электрона на свою орбиту, которое тоже происходит скачком, испускается излучение определенного количества ( кванта) энергии. Электрон, двигаясь по свойственной для него орбите, никогда не излучает и, следовательно, не теряет энергии движения, как нужно было бы ожидать, исходя из электромагнитной теории света. Эти положения Бора опираются на квантовую теорию света Планка и нашли полное экспериментальное обоснование. [12]
Бор в периодической системе занимает место во втором ряду и относится к числу элементов В-подгрупп. Связи, образуемые атомами элементов этого ряда, обладают наибольшей прочность о. На это указывают малые межатомные расстояния и высокие температуры плавления бора и его ближайших соседей-бериллия и углерода. Такое положение бора накладывает определенный отпечаток на его физико-химические свойства и структурные характеристики. [13]
Такая замещаемость оправдывается одинаковостью атомного состава окислов алюминия ( глинозема) и бора. Деление окислов на основные и кислотные никак не может быть резким, и здесь встречается наиболее убедительное тому доказательство: окислы бора и алюминия относятся именно к числу переходных, близких к самому пределу, разграничивающему кислоты от оснований. Если обратим внимание на хлористые соединения, то заметим, что хлористый литий растворим в воде, мало летуч и водою не разлагается; хлористые бериллий и магний уже более летучи, и хотя не вполне, но водой разлагаются; хлористые же бор и алюминий еще более летучи и водою разлагаемы. Таким образом положение бора и алюминия в ряду других элементов весьма ясно определяется величиною их атомного веса и указывает нам на то, что в этих элементах нельзя ждать новых, резких химических отправлений. [14]
Страницы: 1