Законы - идеальный раствор
Cтраница 1
Законы идеальных растворов позволяют установить зависимость между концентрациями жидкой z и паровой z фаз раствора в состоянии равновесия. [1]
Законы идеальных растворов являются, таким образом, предельными законами, соблюдающимикк. [2]
До сих пор все изложение было основано на допущении, что выполняются законы идеальных растворов, поскольку использовались выражения для константы диссоциации, записанной через концентрации. Как известно, это не совсем точно, в особенности для растворов электролитов, где отклонения от законов идеальных растворов особенно существенны. [3]
До сих пор все изложение было основано на допущении, что выполняются законы идеальных растворов, поскольку использовались выражения для константы диссоциации, записанной через концентрации Кс - Как известно, это не совсем точно, в особенности для растворов электролитов, где отклонения от законов идеальных растворов особенно существенны. [4]
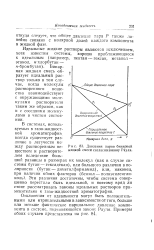 |
Давления паров бинарной жидкой смеси согласно закону Рауля. [5] |
Эти различия достаточны, чтобы система совершенно перестала быть идеальной, и поэтому вряд ли стоит рассматривать законы идеальных растворов применительно к газо-жидкостной хроматографии. [6]
Поэтому определенные таким образом активности веществ при рассмотрении химических равновесий и других реакций, протекающих в концентрированных растворах, позволяют использовать законы идеальных растворов. [7]
Однако эти отклонения становятся малыми при достаточном разбавлении растворов, и поэтому к очень разбавленным ( тео-ретически бесконечно разбавленным) растворам полимеров оказываю 1ся применимыми законы идеальных растворов ( например. Этим обстоятельством пользуется для определения молекулярных весов полимеров. [8]
В начальный период развития научных взглядов на термодинамические свойства веществ путем обобщения опытных данных были установлены такие сравнительно простые закономерности, характеризующие их поведение, как, например, газовые законы, законы идеальных растворов или закон дей-ствующих масс. Эти обобщения сравнительно скудных, приближенных и полученных в узкой области экспериментальных данных обладали преимуществом формальной простоты, допускающей удобную математическую интерпретацию. Однако существенный их недостаток заключался в ограниченности пределов применения, не позволяющей охватить с практически приемлемой точностью все более расширяющуюся массу опытных фактов и данных. Так, применение законов идеального газового состояния допустимо лишь с небольшой степенью точности в условиях, далеко отстоящих от критических. Закон действующих масс, выраженный через обычные концентрации, приводит к серьезным ошибкам и лишь для весьма разбавленных растворов может считаться приемлемым. Подавляющее большинство концентрированных растворов весьма заметно отклоняется в своем поведении от закона Рауля, являющегося лишь первым приближением в установлении соотношений, выражающих свойства растворов. [9]
Соотношения, даваемые уравнениями ( 3), ( 4) и ( 5), каждое из которых изменяется линейно с изменением молярной доли, изображены графически в части I фиг. Законы идеальных растворов, как выражено в предыдущих уравнениях, подразумевают, что в идеальном растворе двух компонентов взаимодействие между неодинаковыми молекулами точно такое же, как и между одинаковыми молекулами. [10]
Большое внимание, уделяемое предельно разбавленным растворам, объясняется их исключительным значением в развитии теории растворов и установлении основных закономерностей идеальных растворов. Законы идеальных растворов были открыты в сущности при работе с предельно разбавленными растворами. [11]
Эти законы - законы идеальных растворов - являются, таким образом, предельными законами, соблюдающимися тем точнее, чем больше сходство между компонентами в отношении размера, формы и энергии молекул. [12]
По [20] для полимерного клубка каждая точка на диаграмме состояний является трик-ритической. В области 1 работают законы идеальных растворов, это так называемая в - область. Здесь корреляционная длина совпадает с линейным размером клубка. В области 2 - раствор разбавленный, но не идеальный. Корреляционная длина также совпадает с линейным размером клубка. В области 3 - раствор полуразбавленный, но сегменты относительно изолированы друг от друга. [13]
Следовательно, формулы, выведенные для описания скорости возникновения зародышей в гомогенном растворе, применимы в известных условиях и для гетерогенных систем. Уместно вспомнить, что законы идеальных растворов оказываются применимыми для описания свойств реальных, даже если концентрация последних сравнительно велика. Здесь имеется аналогичный случай. [14]
Выражение ( 43) чаще всего применяют в комбинированных методах исследования парожидкостного равновесия, а выражения ( 45) - ( 47) - при использовании уравнений состояния. Если для описания свойств газовой и жидкой фаз используют законы идеальных растворов, то коэффициенты активности i - ro компонента в этих фазах равны единице. [15]
Страницы: 1 2 3