Стехиометрические законы - химия
Cтраница 1
Стехиометрические законы химии - постоянства состава, эквивалентов и кратных отношений - были в свое время сформулированы применительно к молекулам, а потому справедливы для молекулярной формы вещества. Для немолекулярных структур постоянство состава и вытекающие из него следствия не являются уже критерием образования химических соединений. Поэтому в настоящее время стехиометрические законы химии формулируются с учетом единства молекулярной и немолекулярной форм существования вещества. [1]
Стехиометрические законы химии - постоянства состава, эквивалентов и кратных отношений - были в свое время сформулированы применительно к молекулам, а потому справедливы для молекулярной формы существования вещества. Для немолекулярных структур постоянство состава и вытекающие из него следствия не являются уже критерием образования химических соединений. Поэтому в настоящее время стехиометрические законы химии формулируются с учетом единства молекулярной и немолекулярной форм существования вещества. [2]
Следует отметить, что стехиометрические законы химии ( постоянства состава, эквивалентов, кратных отношений) справедливы только для дальтонидов. [3]
Дальтон же впервые сделал эту мысль конкретной: при ее помощи он первый объяснил стехиометрические законы химии и первый на основании этих законов указал эмпирический путь точного измерения атомных весов. [4]
Однако если задолго до Дальтона уже была высказана мысль о различной весомости атомов, то это было сделано лишь в самой общей, самой абстрактной форме; Дальтон же впервые сделал эту мысль конкретной: опираясь на нее, он первый объяснил стехиометрические законы химии и первый на основании этих законов указал эмпирический путь точного измерения атомных весов. [5]
Стало очевидным, что стехиометрические законы химии являются не всеобщими, а частными законами природы. [6]
Общая химия неразрывно связана с неорганической химией и является теоретическим введением в нее. По-новому излагаются вопросы химической атомистики, стехиометрические законы химии. Дана современная трактовка природы металлической связи. На базе Периодической системы, физико-химического анализа и природы металлической связи изложена теория взаимодействия металлов друг с чг - и с неметаллами с образованием металлических фаз. [7]
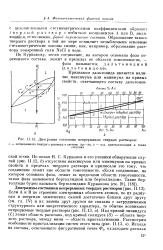 |
Диаграмма состояния непрерывных твердых растворов. [8] |
А или В, являющийся, естественно, фазой переменного состава. Образование такого твердого раствора в той же мере оставляет незыблемыми основные стехиометрические законы химии, как, например, образование раствора поваренной соли NaCl в воде. [9]
 |
Дистектические диаграммы состояния с твердыми растворами. [10] |
АВ) с целочисленными стехиометрическими коэффициентами образует твердый раствор с избытком компонентов А или В, являющийся, естественно, фазой переменного состава. Образование такого твердого раствора в той же мере оставляет незыблемыми основные стехиометрические законы химии, как, например, образование раствора поваренной соли NaCl в воде. [11]
Стехиометрические законы химии - постоянства состава, эквивалентов и кратных отношений - были в свое время сформулированы применительно к молекулам, а потому справедливы для молекулярной формы вещества. Для немолекулярных структур постоянство состава и вытекающие из него следствия не являются уже критерием образования химических соединений. Поэтому в настоящее время стехиометрические законы химии формулируются с учетом единства молекулярной и немолекулярной форм существования вещества. [12]
Стехиометрические законы химии - постоянства состава, эквивалентов и кратных отношений - были в свое время сформулированы применительно к молекулам, а потому справедливы для молекулярной формы существования вещества. Для немолекулярных структур постоянство состава и вытекающие из него следствия не являются уже критерием образования химических соединений. Поэтому в настоящее время стехиометрические законы химии формулируются с учетом единства молекулярной и немолекулярной форм существования вещества. [13]
Стехиометрические законы химии - постоянства состава, эквивалентов и кратных отношений - были в свое время сформулированы применительно к молекулам, а потому справедливы для молекулярной формы вещества. Для немолекулярных структур постоянство состава и вытекающие из него следствия не являются уже критерием образования химических соединений. Поэтому в настоящее время стехиометрические законы химии формулируются с учетом единства молекулярной и немолекулярной форм существования вещества. [14]
Страницы: 1