Понижение - обменная емкость
Cтраница 1
Понижение обменной емкости при нагревании ионитов КФС на воздухе авторы [151 ] справедливо объясняют десульфиро-ванием. [1]
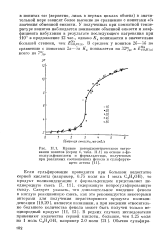 |
Кривые потенциометрического титрования ионитов ( серии б, на основе п-фе-нолсульфокислоты п формальдегида, полученных при различных соотношениях фенола и сульфирующего агента. [2] |
У полученных при комнатной температуре ионитов наблюдается понижение обменной емкости и коэффициента набухания в результате последующего нагревания при 110 в продолжение 12 час. [3]
Во избежание значительного десульфированпя ( а следовательно, соответственного понижения обменной емкости ионита) предлагается проводить начальную стадию конденсации фенолсульфо-кислоты с формальдегидом в разбавленном растворе. Затем реакционная смесь доводится до кипения, причем удаляется вода и достигается значительное ускорение поликонденсации. Одновременно удаляется избыток формальдегида, благодаря чему предотвращается десульфирование в процессе отверждения. Если судить по приведенному [198] описанию, то остается не вполне ясным, как представляет себе автор течение реакции иоликонденсации и образование нерастворимого продукта при недостатке формальдегида. [4]
Сюда, например, относится интересный и важный вопрос о причинах единовременного понижения обменной емкости ионитов по СООН-группам в результате кислотного или щелочного гидролиза. По нашему мнению, высказанные также авторами суждения об отсутствии в синтезированных ими ионитах неионогенных функциональных групп, содержащих серу, нуждаются в дополнительных подтверждениях. Авторы [73, 103 -107] убедительно показали целесообразность применения дихлорэтана в процессе синтеза ионитов. Возможно, что при изучении влияния условий получения ионитов на их свойства представляла бы интерес постановка опытов синтеза в присутствии и отсутствии дихлорэтана. Очевидно, что участие последнего в реакциях, приводящих к получению ионитов, не ограничивается только ролью инертного разбавителя. [5]
Обменная емкость анионита АН-1 уменьшилась особенно в ОН-форме ( - 20 %), тогда как обменная емкость анионита ЭДЭ-10П практически не изменилась, что несколько неожиданно, так как при действии водного раствора перекиси водорода этот сорбент легко окисляется с понижением обменной емкости. [6]
Рекомендуется не предусматривать периодической смены иони-тов, обменная емкость которых мало уменьшается с длительностью эксплуатации ( как правило, все катиониты), а также анионитов с малой осмотической прочностью, приводящей к необходимости удаления из фильтра более 25 % материала в год в виде мелких - не рабочих фракций. В этих случаях понижение обменной емкости ионитов с длительностью их использования компенсируется досыпкой свежих материалов. [7]
Рекомендуется не предусматривать периодической смены ионитов, обменная емкость которых мало уменьшается с длительностью эксплуатации ( как правило, все катиониты), а также анионитов с малой осмотической прочностью, приводящей к необходимости удаления из фильтра более 25 % материала в год в виде мелких не рабочих фракций. В этих случаях понижение обменной емкости ионитов с длительностью их использования компенсируется досыпкой свежих материалов. [8]
По ионному обмену опубликовано несколько работ [1-4] о термической устойчивости водородных форм сульфокатионитов, в которых дана качественная и количественная характеристика явлений, сопровождающих нагревание этих высокополимерных электролитов в воде. В некоторых статьях [1,2] высказаны соображения о механизме понижения обменной емкости водородных форм сульфокатионитов, гидролизующих при нагревании с образованием 2 мг-экв серной кислоты на каждый миллиэк вивалент отщепляющихся сульфогрупп. [9]
Воздействие высоких температур, как правило, снижает обменную емкость и приводит к деструкции ионита. При низких температурах наблюдается механическое разрушение зерен ионита и в отдельных случаях понижение обменной емкости. [10]
Последние эффекты могут быть интерпретированы как перекрывание нескольких ионогенных групп одним органическим про-тивоионом, способным образовать ионную связь лишь с одним фиксированным ионом, в результате чего соседние ионогенные группы ( или группа) оказываются недоступными для органического противоиона. Для малых ионов органических веществ, например триэтилбензиламмония ( ТЭБА), понижение обменной емкости ионита обычно не меняет относительной обменной емкости. [11]
 |
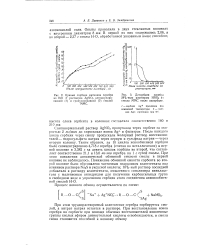
Сорбция воды частично сульфированными полистирольными смолами с 8 % ДВЕ. [12] |
На основании данных рис. 46 можно сделать вывод, что сульфированный полистирол с емкостью около 3 0 мг-экв / г лучше всего подходит для разделения трех кетонов и, вероятно, для других смесей сильно гидрофобных неэлектролитов. Скорость приближения к равновесному состоянию с понижением обменной емкости уменьшается настолько резко, что сульфированные смолы, емкость которых намного меньше 4 мг-экв / г, не дают удовлетворительного разделения. [13]
 |
Кривые сорбции катионов серебра из 0 01 N растворов AgNOs негранулированной ( / и гранулированной ( 2 смолой ММС.| Десорбция серебра 28 % - ным раствором UNO3 из смолы ММС после адсорбции. [14] |
Сантинормальный раствор AgNO3 пропускали через сорбент со скоростью 2 мл / мин до проскока ионов Ag в фильтрат. Таким образом, за 10 циклов ионообменной сорбции было сконцентрировано 4 718 г серебра ( считая на металлическое) в первой колонке и 3 382 г за девять циклов сорбции во второй, что составляет соответственно 21 1 и 13 0 мг-экв серебра на 1 г сухой смолы. Понижение обменной емкости сорбента во второй колонке было обусловлено частичным гидролизом ксантогената под влиянием раствора N328 и уксусной кислоты; 10 % - ный раствор последней добавляли к раствору ксантогената, омыленного сополимера винилаце-тата с малеиновым ангидридом для получения карбоксильных групп в свободном виде и упрочнения сорбции этого соединения анионообмен-ной смолой Н - О. [15]
Страницы: 1