Понижение - коэффициент - активность
Cтраница 1
Понижение коэффициента активности в этой области объясняют уменьшением реакционной способности ионов вследствие влияния межионных сил. Однако можно поставить вопрос о физическом смысле f за границей минимальных значений, особенно при большом ц, когда / может быть значительно больше единицы. [1]
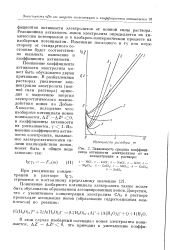 |
Зависимость средних коэффициентов активности электролитов от их концентрации в растворе. [2] |
Понижение коэффициента активности электролита может быть обусловлено двумя причинами. [3]
Шон [32] объясняет такое понижение коэффициентов активности сорбированного ионитом электролита исходя из того, что ионит состоит из электрически заряженных поверхностей. В своих расчетах Шон применял уравнение Шофилда, выведенное последним с помощью теории двойного электрического слоя Гои - Чапмена. Предположив, что радиус кривизны заряженных поверхностей гораздо больше расстояния между ними и что электрические двойные слои не совпадают друг с другом в центре канала, разделяющего заряженные поверхности, Шон определил расстояние между этими поверхностями равным 60 А при плотности электрических зарядов, равной 2 25 - 10 -: 10 фарадей / см2, что соответствует расстоянию между зарядами нга поверхности в 9 А. Он пришел к выводу, что электрические заряды распределены в ионите неравномерно и поэтому доннановское уравнение, верное для гомогенной фазы, нельзя применять к ионообменным смолам. [4]
Шон [32] объясняет такое понижение коэффициентов активности сорбированного ионитом электролита исходя из того, что ионит состоит из электрически заряженных поверхностей. В своих расчетах Шон применял уравнение Шофилда, выведенное последним с помощью теории двойного электрического слоя Гои - Чапмена. Предположив, что радиус кривизны заряженных поверхностей гораздо больше расстояния между ними и что электрические двойные слои не совпадают друг с другом в центре канала, разделяющего заряженные поверхности, Шон определил расстояние между этими поверхностями равным 60 А при плотности электрических зарядов, равной 2 25 - 10 - 10 фа-радей / смг, что соответствует расстоянию между зарядами на поверхности в 9 А. Он пришел к выводу, что электрические заряды распределены в ионите неравномерно и поэтому доннановское уравнение, верное для гомогенной фазы, нельзя применять к ионообменным смолам. [5]
Теоретически оно может быть объяснено понижением коэффициента активности в разбавленных растворах по мере роста ионной силы. [6]
Это, явление может быть интерпретировано как понижение коэффициента активности одного из компонентов в присутствии другого или как образование смешанного ассоциата. Эти данные показывают, что при экстракции тетрахлор - и тетрабромферраты ТДА практически не образуются. Позднее [202] была изучена экстракция хлорного железа хлоридом ТДА в хлороформе. Полученное значение lgipu2 25 свидетельствует о высокой прочности смешанного ассоциата и в этом растворителе. [7]
Вероятно, оно связано не только с понижением коэффициента активности соли, но и с образованием ионов полигидрофторидов. [8]
Несмотря на это, следует все же отметить, что они имеют большое значение для обнаружения аномальных понижений коэффициентов активности, которые препятствуют применению шкалы Я о для измерения термодинамических рКа - Однако метод растворимости может быть с успехом применен в случае некоторых других соединений. [9]
Повышение растворимости в воде малорастворимого электролита при добавлении солей, не содержащих общих с ними исков, может быть объяснено понижением коэффициента активности в разбавленных растворах по мере роста ионной силы. [10]
Так как поверхность белковой глобулы доступна для растворителя как в иативном, так и в денатурированном состоянии, денатурация должна, следовательно, приводить к понижению коэффициентов активности внутренних боковых групп белка, которые становятся доступными для растворителя. Диссоциацию и растворение белков можно рассматривать таким же образом, относя коэффициенты активности к поверхностным участкам, доступность которых для растворителя меняется в этих процессах. В случае осаждения, однако, имеется осложняющий фактор, состоящий в том, что состав твердой фазы может не быть постоянным. Так, осаждение трихлорацетатом и перхлоратом в кислом растворе, вероятно, сопровождается связыванием этих анионов катионными белками, что приводит к уменьшению заряда белка и в результате этого к осаждению его в виде комплекса с солью. До тех пор, пока состав обеих фаз остается постоянным, объяснение вызываемых солью процессов денатурации, осаждения и агрегации сводится к определению, у каких боковых групп изменяются коэффициенты активности ( или растворимость) в присутствии данной соли. [11]
Если состав насыщенного раствора характеризуется нисходящей ветвью кривой, то действуют два противоположно направленных фактора: присутствие общего иона обусловливает снижение растворимости, а повышение общей концентрации - понижение коэффициента активности и повышение растворимости. [12]
Высокая плотность положительного заряда на поверхности мицеллы бромида цетилтриметиламмония должна стабилизировать отрицательно заряженные ионы и переходные комплексы, так что в этих случаях наблюдаемое ускорение реакций можно рассматривать как результат возрастания локальной концентрации ионов гидроксила вблизи субстрата, адсорбированного на поверхности мицеллы. Активность иона гидроксила должна быть постоянной для системы в целом, так что понижение коэффициента активности вблизи мицеллы должно приводить к возрастанию концентрации ионов гидроксила в этой области. [13]
 |
Растворимость аденина в присутствии. пурина О, уридина. цитидина л, пиримидина Q, фенола, циклогоксанола, мочевины д. [14] |
Таким образом, одним из факторов, способных вызывать денатурацию ДНК, является такое изменение в природе растворителя, при котором он начинает предпочтительно взаимодействовать с основаниями нуклеиновых кислот, становящимися при денатурации более доступными. Это подтверждается экспериментально повышением растворимости и понижением коэффициента активности оснований нуклеиновых кислот в таких растворителях. [15]
Страницы: 1 2