Понижение - порядок - реакция
Cтраница 1
Понижение порядка реакции объясняется тем, что в присутствии катализатора реакция идет через несколько элементарных стадий, порядок которых может быть меньше порядка некаталитических реакций. Различное влияние скорости элементарных стадий на общую скорость каталитической реакции нередко приводит к дробному ее порядку. [1]
В присутствии катализатора-кислоты происходит понижение порядка реакции по концентрации воды. В отношении того, происходит ли перенос трех протонов по механизму ( 99) синхронно или последовательно, было высказано много разных соображений. Поскольку лишь некоторые из них являются убедительными, мы не будем обсуждать здесь указанную проблему. [2]
Известно, однако, что понижение порядка реакции при уменьшении парциального дав ления реагента характеризует переход от гомогенной реакции к реакции на поверхности. На возможность гетерогенной реакции в этих условиях указывают также V, данные авторов [101-115] по каталитическому окислению окиси азота. Более высокие значения констант скорости 3-го порядка в условиях опытов [94, 122-126] могут быть обусловлены также и неконтролируемой адсорбцией окиси азота на стенках реакционного сосуда. [3]
Можно заметить, что при прочих равных условиях скорость реакции увеличивается при понижении порядка реакции. [4]
При концентрации Ск 0 2 М член k2CR в знаменателе становится больше k -, Что приводит к понижению порядка реакции по реагенту. [5]
Однако не исключено, что этот порядок обусловлен нарушением идеальных в кинетическом смысле условий при высоких концентрациях полимера. Вполне вероятно, что понижение порядка реакции объясняется так называемым гель-эффектом или эффектом Троммсдорфа. Сущность этого эффекта заключается в следующем. [6]
Уксусная кислота, нитрометан, азотная и сорная кислоты являются растворителями повышенной полярности. Найдено, что увеличение полярности среды неизменно приводит к увеличению скорости нитрования, иногда с понижением порядка реакции. Таким образом, механизм реакции нитрования должен включать стадию, управляющую скоростью, при которой суммарный заряд ионов не меняется. [7]
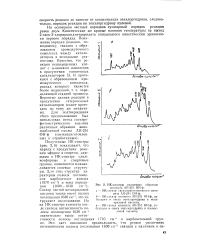 |
ИК-спсктры различных образцов. [8] |
На основании частных порядков суммарный порядок реакции равен двум. Кинетические же кривые влияния температуры на выход 2-окси - З - хлорпропилметакрилата описываются кинетическим уравнением первого порядка. Понижение порядка реакции, по-видимому, связано с образованием промежуточного комплекса между катализатором и исходными реагентами. Вероятно данная реакция в присутствии гетерогенных катализаторов может протекать по тому же механизму. [9]
Так, в отличие от кислотно-каталитической, термическая реакция не ускоряется, а существенно замедляется в тяжелой воде. Если в 20 % - ном водном диоксаие скорость кислотно-каталитической реакции ускоряется в 1 7 раза по сравнению с водной средой Ш, то скорость термической реакции в этом растворителе практически та же, что и в воде. Наконец, об изменении механизма свидетельствует и упомянутое выше понижение порядка реакции. В настоящее время дать исчерпывающее объяснение механизма термического диспропорционири-вания формальдегида не представляется возможным. Этот вопрос заслуживает дальнейшего изучения. [10]
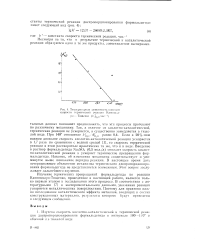 |
Температурная зависимость констант скорости термической реакции Кашшида. [11] |
Так, в отличие от кислотно-каталитической, термическая реакция не ускоряется, а существенно замедляется в тяжелой воде. Если в 20 % - ном водном диоксане скорость кислотно-каталитической реакции ускоряется в 1 7 раза по сравнению с водной средой [1], то скорость термической реакции в этом растворителе практически та же, что и в воде. Наконец, об изменении механизма свидетельствует и упомянутое выше понижение порядка реакции. В настоящее время дать исчерпывающее объяснение механизма термического диспропорциониро-вания формальдегида не представляется возможным. Этот вопрос заслуживает дальнейшего изучения. [12]
Страницы: 1