Понижение - растворимость - соль
Cтраница 1
Понижение растворимости соли посредством введения в раствор веществ, образующих с ней нерастворимые или менее растворимые, чем сама соль, комплексы. Этот метод, однако, требует дальнейшей химической переработки полученных комплексных соединений. [1]
Насыщение аммиаком ведут для понижения растворимости соли. Вместо NHS можно продукт высаливать с помощью NaCl, но последний загрязняет препарат. [2]
Насыщение аммиаком ведут для понижения растворимости соли. Вместо NHj можно продукт высаливать с помощью NaCl, но последний загрязняет препарат. [3]
 |
Изотерма 25 взаимной системы NaCla MgSO4 MgCI2 Na2S04. [4] |
Положение линии XI - XIV и XVI - XV на диаграмме указывает на взаимное понижение растворимости солей NaCl и NaaS04, содержащих одно-именный ион натрия. [5]
Осаждение PbSO4 позволяет отделять его от большого числа элементов, образующих растворимые сульфаты. Для понижения растворимости соли осаждение проводится из раствора, содержащего избыток H2SO4, или при прибавлении к раствору этилового спирта. [6]
 |
Образование накипи в секциях водогрейного котла, питаемого обычной московской водопроводной водой ( а и омагпичсп-ной ( о. [7] |
В системах охлаждения накипь образуется при температуре выше 30 С. Это связано с понижением растворимости солей жесткости и интенсивным распадом бикарбонатов при температуре выше 40 С. [8]
В системах охлаждения образование накипи происходит при температуре выше 30 С. Это связано с понижением растворимости солей жесткости и интенсивным распадом бикарбонатов при температуре выше 40 С. [9]
Трудности возникают в тех случаях, когда образующиеся четвертичные ониевые соли гидрофильны и в заметной степени остаются в водной фазе или когда оба аниона имеют близкие по величине константы экстракции. Другим возможным решением проблемы является понижение растворимости соли R N в воде в результате использования концентрированных растворов гидроксида натрия в качестве водной фазы. [10]
В области низких концентраций зависимость носит линейный характер. И только на участке высоких концентраций кислоты градиент понижения растворимости соли становится меньше. При - повышении температуры растворимость соли увеличивается во всей изученной области концентраций кислоты. При этом с увеличением содержания кислоты разница в растворимости нитрата магния при 25 и 50 С становится больше. [11]
Сульфокислоту выделяют в виде хорошо кристаллизующейся натриевой соли. Как и при выделении натриевой соли толуол-сульфокислоты, для понижения растворимости соли при кристаллизации к раствору прибавляют хлористый натрий. [12]
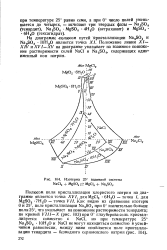 |
Изотерма 25 взаимной системы NaCl2 MgSO4 MgCl2 Na2S04. [13] |
На диаграмме - полюсом путей кристаллизации Na2SO4 и Na2S04 ЮН2О является точка XI. Положение линии XI - XIV и XVI - XV на диаграмме указывает на взаимное понижение растворимости солей NaCl и Na2S04, содержащих одноименный ион натрия. [14]
 |
Осаждение ниобия в виде соли в присутствии титана из раствора. [15] |
Страницы: 1 2