Понижение - энтропия
Cтраница 3
Замедление реакции алкильными заместителями, поэтому, обусловлено понижением энтропии активации. [31]
Значительное повышение температуры плавления ароматических полимеров должно быть обусловлено понижением энтропии плавления. Однако величины энтропии плавления, рассчитанные на единичную связь, для ароматических полиэфиров даже несколько выше, чем для линейных. [32]
С другой стороны, однако, межмолекулярный катализ сопровождается неблагоприятным понижением энтропии, активации, обусловленным прежде всего потерей поступательного ( а частично и вращательного) движения дополнительной ( каталитической) частицы [ см. § 5 гл. В связи с этим реакции высокого кинетического порядка отличаются малой эффективностью в разбавленном растворе. [33]
Уиберг приписывает это энтропийному эффекту; группа п орта-положении уменьшает понижение энтропии при переходе от реагента к четырехчленному переходному состоянию. Исключение представляет соединение с o - mpem - бутилыюй группой, для которого сутцестяенпо пространственное сжатие. В более поздней статье Уибсрг [11] обсуждает различные типы реакций, в которых имеют место внутримолекулярные 1 3-пе-реходы. [34]
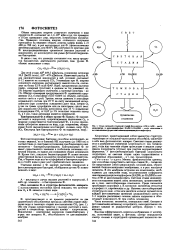 |
Схема световой и темповой стадий фотосинтеза. АТФ Е АДФ - фотв. адеиозинтри - и адеиозицднфоофаг, НАДФ н НАДФН - соотв. окисленная н восстановленная формы никотянамццаденнншнуклеотццфосфата. [35] |
Для этой р-ции ДН 469 3 кДж / моль, понижение энтропии 30 3 Дж / ( К МОЛь), ДС - 479 кДж / моль. [36]
Эта энергия F - уже независимо от модели - определяется понижением энтропии при жестком ограничении взаимного расположения в пространстве двух соседних звеньев. [37]
В общем для процессов с участием элементарного азота характерны эндотермичность, понижение энтропии и низкие скорости при обычных температурах. [38]
Соотношение между энтропией информации и количеством информации термодинамически подобно соотношению между понижением энтропии идеального газа и совершенной над ним работой: количество информации Винера и выражает эту работу. Затрата работы ведет к повышению свободной энергии полученной информации и делает ее термодинамически неустойчивой. [39]
Уиберг приписывает это энтропийному эффекту; группа в opmo - положении уменьшает понижение энтропии при переходе от реагента к четырехчленному переходному состоянию. Исключение представляет соединение с o - mpe / n - бутильной группой, для которого существенно пространственное сжатие. В более поздней статье Уиберг [11] обсуждает различные типы реакций, в которых имеют место внутримолекулярные 1 3-пе-реходы. [40]
Известно, что растворение неполярных газов метанового ряда сопровождается выделением тепла и понижением энтропии, т.е. повышением СО воды. Молекула газа, не вступая непосредственно в химическую связь с водой, связывает в гидрат в растворе метана, этана, пропана и н-бутана соответственно 15, 20, 27 и 33 молекулы воды. Следовательно, можно считать, что существование градиента концентрации углеводородов ( УВ) в поровой жидкости подземной гидросферы является тем главным воздействием, которое обусловливает неравновесность системы. Это внешнее воздействие получает отражение в структуре жидкости в форме градиента СО, в соответствии с которым зарождаются энтропоосмотические микропотоки, т.е. кооперативное движение частиц раствора. [41]
Процесс адсорбции сопровождается уменьшением числа степеней свободы и, как следствие, понижением энтропии и подвижности цепей - отсюда общее использование термина упорядочение. Легко представить такой процесс в случае малых частиц, для которых даже тонкий слой адсорбированного и закрепленного за счет зацеплений полимера ( скажем, толщиной в 10 - 100 А) может составлять значительную долю полимера, обладающего свойствами, отличными от свойств в блоке. Толщина слоя такого порядка величины, очевидно, совпадает с расстоянием, на которое распространяется действие типичных сил поверхностного поля. Некоторые исследователи считают, что зона влияния значительно больше ( 103А или более [515, 517]) благодаря существованию кооперативных сегментальных эффектов, действующих далеко от поверхности. [42]
 |
Мономолекулярная пленка жирной кислоты на поверхности воды. R - углеводородная группа. [43] |
Термодинамические исследования показывают, что нерастворимость углеводородов в воде определяется прежде всего понижением энтропии, возрастанием упорядоченности системы. [44]
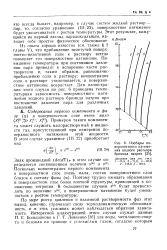 |
Изобары по. [45] |
Страницы: 1 2 3 4