Понижение - энтропия - система
Cтраница 1
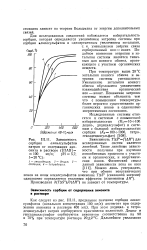 |
Зависимость сорбции алкилсульфатов натрия от содержания анионита в растворе ( [ ПАВ ] 100 мг / л. рН 5 7. / 20 С. [1] |
Понижение энтропии системы можно объяснить тем что с повышением температуры более вероятно существование органических ионов в одинаковых энергетических состояниях. [2]
Повторим снова, что понижение энтропии системы, вызываемое образованием конструкций ( и тем более, имеющих смысл) пренебрежимо мало по сравнению с тепловой частью. Поэтому, никакое повышение сложности конструкции не способно толкать макроскопическую систему к какой-либо определенной цели. Кстати, онзагеровская неравновесная термодинамика не отличает энтропию конструкции от тепловой. [3]
Уменьшение объема при смешении приводит к понижению энтропии системы, что создает условия для появления расслоения при повышении температуры. [4]
Нужно заметить, что для неизолированной системы понижение энтропии в процессе превращения, вообще говоря, возможно. Это понижение энтропии системы будет скомпенсировано возрастанием энтропии внешней среды. Это можно доказать, если объединить изучаемую систему с внешней средой, в результате чего получим изолированную систему. [5]
Хотя для газовых систем энергия полярной формы А, В - обычно выше, чем ковалентной формы АВ, в растворе соотношение энергий для этих двух форм может оказаться обратным, поскольку ионная пара стабилизируется сольватацией. И действительно, во многих полярных растворителях реакции АВ - - А, В - экзотермичны и происходят с понижением энтропии системы из-за того, что молекулы растворителя становятся менее подвижными вокруг ионных пар. Такое же явление наблюдается при конденсации некоторых паров. [6]
Кроме того, само по себе распределение углеводорода внутри мицелл в объеме раствора также увеличивает энтропию системы. Понятно также, что с ростом длины цепи молекулы мыла и одновременно с уменьшением растворимости углеводорода относительный вклад структурных изменений в воде, производимых углеводородами при понижении энтропии системы, уменьшается и, следовательно, уменьшается и влияние углеводородов на ККМ. [7]
Действительно, как показали слектры ЯМР, в водных растворах вблизи молекул углеводородов период релаксации молекул воды в два раза больше, чем в воде, не содержащей растворенных углеводородов. Растворение углеводорода в воде приводит к равномерному распределению его молекул и, следовательно, к росту энтропии, однако из-за низкой растворимости углеводородов это увеличение энтропии не может компенсировать понижение энтропии системы, обусловленное структурированием воды в таком растворе. Уменьшение энтропии компенсирует процесс, ведущий к уменьшению границы контактов углеводородных цепей с водой, - ассоциацию углеводородных радикалов молекул ПАВ. В результате такой ассоциации уменьшается доля жидкости с повышенной структурированностью, и абсолютная величина понижения энтропии в растворе углеводородов или ПАВ становится равной абсолютной величине прироста энтропии, вызванного растворением углеводородов. Если в воде растворен углеводород, это явление ограничивает его растворимость и приводит к появлению углеводородной макрофазы ( жидкости) на границе с насыщенным водным раствором. Если же в растворе находятся дифильные молекулы ПАВ, ассоциация углеводородных радикалов не приводит к образованию макрофазы, так как этому препятствует гидратация полярных групп молекул или электростатическое отталкивание их ионов. В растворе ПАВ уменьшение энтропии, вызванное усилением структур жидкой воды, компенсируется увеличением степени ассоциации ПАВ и обусловливает появление критической концентрации ми-целлообразования. [8]
В результате ассоциации контактные поверхности субъединиц оказываются скрытыми. Это может быть представлено как перенос поверхности ( атомов) из воды во внутреннюю часть белка. Параллельно происходит понижение энтропии системы, поскольку ассоциированные мономеры ( олигомеры) характеризуются более высокой упорядоченностью, чем свободные. [9]
В результате ассоциации контактные поверхности субъединиц оказываются скрытыми. Это может быть представлено как перенос поверхности ( атомов) из воды во внутреннюю часть белка. Параллельно происходит понижение энтропии системы, поскольку ассоциированные мономеры ( олигомеры) характеризуются более высокой упорядоченностью, чем свободные. [10]
Здесь важно подчеркнуть, что говоря о специальности ( или, скажем, особенности) состояния с низкой энтропией, мы, на самом деле, имеем ввиду именно явную специальность. Если этого не оговорить, то при более детальном рассмотрении мы могли бы увидеть, что высокоэнтропийные состояния в подобных ситуациях будут такими же специально упорядоченными, как и низкоэнтропийные, благодаря чрезвычайно точной координации движений отдельных частиц. Например, кажущееся случайным движение молекул воды, просочившейся между половицами после того, как стакан разбился, является, на самом деле, вполне специальным: эти перемещения настолько точны, что если их обратить, то получится то самое исходное низкоэнтропийное состояние, в котором восстановленный стакан покоится на столе. Это должно быть именно так, поскольку обращение всех этих движений полностью соответствует обращению направления времени, в результате которого стакан, разумеется, восстановил бы себя и запрыгнул обратно на стол. Но подобное скоординированное движение всех молекул воды - совсем не та специальность, которую мы имеем ввиду, говоря о низкой энтропии. Энтропия относится к явному беспорядку. Порядок же, относящийся к точной координации движений частиц, не есть явный порядок, и потому он не приводит к понижению энтропии системы. [11]
Страницы: 1