Понимание - периодическая система
Cтраница 1
Понимание периодической системы не может быть полным, пока мы не выяснили свойств атомных ядер, в которых сосредоточена почти вся масса и вся энергия атома. [1]
На основе сказанного выявляются очень важные для понимания периодической системы и для установления связи ее со строением атома математические з а к о-номер ности, выражающие собой сложность закона развития материи. [2]
 |
Схема расщепления группы на подгруппы. [3] |
На основе сказанного выявляются очень важные для понимания периодической системы и для установления связи ее со строением атома математические закономерности собой сложность закона развития материи. [4]
По мере того как росло понимание роли электрона в свойствах элементов, появлялось и понимание периодической системы. Около 1923 г. стало очевидно, что для объяснения линий спектра надо определить различные энергетические состояния атома, для чего необходимы четыре квантовые числа. Но, как видно из спектров, все электроны тяжелого атома не могут одновременно находиться в этом состоянии. Поэтому нельзя ожидать дальнейшего развития науки об атоме, пока не будет найден закон, показывающий, как должны быть распределены электроны по возможным энергетическим состояниям. Такой закон был открыт в 1925 г. и получил название принцип исключения Паули. Согласно этому закону, в атоме не может быть двух электронов, у которых все четыре квантовых числа одинаковы. [5]
По мере того как росло понимание роли электрона в свойствах элементов, появлялось и понимание периодической системы. Около 1923 г. стало очевидно, что для объяснения линий спектра надо определить различные энергетические состояния атома, для чего необходимы четыре квантовые числа. [6]
По мере того как росло понимание роли электрона в свойствах элементов, появлялось и понимание периодической системы. Около 1923 г. стало очевидно, что для объяснения линий спектра надо определить различные энергетические состояния атома, для чег необходимы четыре квантовые числа. [7]
По мере того как росло понимание роли электрона в свойствах элементов, появлялось и понимание периодической системы. Около 1923 г. стало очевидно, что для объяснения линий спектра надо определить различные энергетические состояния атома, для чего необходимы четыре квантовые числа. [8]
По мере того как росло понимание роли электрона в свойствах элементов, появлялось и понимание периодической системы. Около 1923 г. стало очевидно, что для объяснения линий спектра надо определить различные энергетические состояния атома, для чего необходимы четыре квантовые числа. Из всех возможных состояний электрон переходит в то, которому соответствует наименьшая энергия; этому состоянию соответствуют следующие значения квантовых чисел: п 1, / 0, т 0, ms / 2 - Но, как видно из спектров, все электроны тяжелого атома не могут одновременно находиться в этом состоянии. Поэтому нельзя ожидать дальнейшего развития науки об атоме, пока не будет найден закон, показывающий, как должны быть распределены электроны по возможных энергетическим состояниям. Такой закон был открыт в 1925 г. и получил название принцип исключения Паули. Согласно этому закону, в атоме не может быть двух электронов, у которых все четыре квантовых числа соответственно одинаковы. [9]
 |
Соотношение между часто - F M. [10] |
Это показало, что порядковый номер имеет большее значение, чем атомный вес, и, возможно, является ключом к пониманию периодической системы элементов. [11]
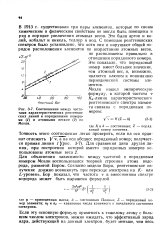 |
Соотношение между частотами характеристических рентгеновских линий и порядковыми номерами ( / и атомными весами ( 2 по Мозли. [12] |
Это показало, что порядковый номер имеет большее значение, чем атомный вес, и, возможно, является ключом к пониманию периодической системы элементов. [13]
Сходную с этими магическими словами роль играют инертные газы: они являются ключом к пониманию периодической системы. [14]
Проблеме верхней границы системы и обсуждению характера изменения свойств гипотетических сверхэлементов посвящена данная книга. Такого рода рассмотрение требует определенного методологического подхода, каковым, на наш взгляд, является понимание периодической системы как упорядоченного множества химических элементов. [15]
Страницы: 1 2