Понятие - порядок - реакция
Cтраница 1
Понятие порядка реакции в простейших случаях близко к понятию молекулярности реакции, которое определяется числом молекул, участвующих в каждом элементарном химическом акте. [1]
Однако понятие порядка реакции не всегда отражает молекулярный механизм реакции. Это связано с тем, что не во всех случаях сразу после столкновения молекул происходит элементарный акт химического превращения. Часто при столкновениях сначала образуются промежуточные вещества, которые только несколько позже превращаются в продукты реакции. В таких случаях скорость реакции непосредственно не определяется частотой соударений частиц. [2]
Таким образом, понятие порядка реакции - эмпирическое, а молекулярности - теоретическое. [3]
Таким образом, понятие порядка реакции эмпирическое, а молекулярное теоретическое. [4]
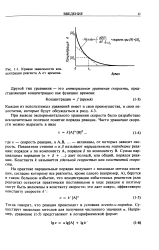 |
Кривая зависимости концентрации реагента А от времени. [5] |
При выводе экспериментального уравнения скорости было разработано исключительно полезное понятие порядка реакции. [6]
В предыдущих разделах мы часто обращались к понятию порядка реакции и использовали его каждый раз, когда это было возможно, для характеристики кинетических кривых. Порядок реакции - очень важная величина, поэтому его определение является стандартной процедурой. Как уже отмечалось во введении, порядки реакции могут иметь физический смысл при условии, что они простые положительные целые числа. Поэтому цель установления порядка реакции сводится к проверке того, следует ли реакция в данных условиях эксперимента закону скорости первого или второго порядка. [7]
Существуют некоторые неправильные представления, связанные с понятием порядка реакции. Во-первых, не о всех реакциях можно сказать, что они имеют какой-то определенный порядок. [8]
Поэтому для характеристики кинетики экспериментально изучаемых химических реакций вводится понятие порядка реакции, которое определяется по-уравнению зависимости скорости реакции от концентрации реагирующих веществ. [9]
Для классификации реакций по характеру их зависимости от концентрации реагирующих веществ введено понятие порядка реакции. Порядок реакции равен сумме степеней, в которых возведены концентрации реагирующих веществ в уравнении скорости реакции. [10]
Вант-Гоффу принадлежит заслуга в установлении различия между порядком реакции и ее молекулярностью. Понятие порядка реакции относится к ее дифференциальному уравнению, а молекулярности - к ее механизму. [11]
Из двух рассмотренных выше примеров реакция водорода с иодом - это реакция второго порядка, причем как по водороду, так и по иоду порядок ее равен единице. Понятие порядка реакции неприменимо к взаимодействию водорода с бромом, так как выражение для скорости этого процесса записано не в соответствующей форме. [12]
В этом и состоит задача неформальной кинетики. В неформальном смысле понятие порядка реакции применимо: а) к реакциям, скорость которых можно выразить уравнением ( 1 - 4), где показатели степени - простые положительные целые числа; б) к отдельной стадии сложной реакции ( в терминах формального порядка реакции это называется молекулярностью, т.е. числом частиц, вовлеченных в элементарный процесс); в) к лимитирующей стадии реакции в определенных условиях эксперимента. [13]
Соотношения для замедленной гетерогенной реакции в полной мере могут быть перенесены на замедленную кристаллизацию. Различие заключается лишь в том, что здесь понятие порядка реакции pj лишено смысла. [14]
Химическая кинетика основана на предположении, что кинетическое уравнение, получаемое экспериментально, является суммарным. Чтобы согласовать эти факты, Шпитальский [277] предлагает различать два понятия порядка реакции: 1) химический порядок реакции и 2) кинетический порядок реакции. [15]
Страницы: 1