Замедление - анодная реакция
Cтраница 1
Замедление анодной реакции на корродирующем металле, вызванное контактом с металлом, имеющим более отрицательный потенциал, уменьшает скорость саморастворения металла. [1]
Имеются, однако, случаи, когда замедление анодной реакции нельзя объяснить этими факторами. Так, например, Эршлером [67] было пока-казано, что при растворении под током платины в соляной кислоте скорость процесса уменьшается по экспоненциальному закону со степенью покрытия поверхности электрода кислородом, причем, например, покрытие поверхности всего лишь на 1 % уменьшает скорость растворения металла в 16 раз. [2]
Первые два пути уменьшения коррозии основаны на замедлении анодной реакции и поэтому могут рассматриваться как классические случаи пассивации. Третий путь заключается в ускорении ингибиторами катодной реакции до такой степени, при которой становится возможной пассивация металлов; такие ингибиторы можно в известном смысле также отнести к пассиваторам. Четвертый и пятый пути основаны на замедлении ингибиторами катодной реакции. Это приводит к смещению потенциала металла в отрицательную сторону, что в соответствии с закономерностями электрохимической кинетики должно уменьшить скорость коррозии. Однако этот механизм ничего общего с механизмом пассивирования не имеет. [3]
Это показывает, что пассивационное торможение растворения хрома и никеля связано с замедлением анодной реакции вследствие адсорбции, а не образования фазовых окислов. Пассивация же серебра невозможна за счет этих факторов и требует образования окисного слоя. [4]
Наиболее широко применяют метод катодной защи - j ты, который основан на замедлении анодной реакции при смещении потенциала в отрицательную сторону. Факти - чески при катодной поляризации ( катодной защите) ме - талл становится более устойчивым благодаря достижению потенциала, соответствующего термодинамически рассчитанному значению потенциала равновесия между металлом и ионами металла в растворе. [5]
Из уравнений ( 14 - 10) и ( 14 - 11) видно, что величину а можно рассматривать как часть изменения электродного потенциала АЕ в катодном направлении, которая приводит к ускорению катодной реакции. Подобным же образом величина ( 1-а) обозначает замедление анодной реакции. [6]
Поэтому, сопоставляя результаты опытов по изменению необратимых электродных потенциалов и интенсивности коррозии, можно прийти к заключению, что увеличение интенсивности коррозии при добавлении малых количеств вольфрамата обусловлено увеличением эффективности катодного процесса. Уменьшение интенсивности коррозии при добавлении больших концентраций ингибитора, превышающих критические, вызвано замедлением анодной реакции ионизации металла. [8]
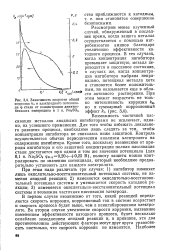 |
Зависимость скорости общей коррозии k0 и электродного потенциала ф стали от концентрации динитро-бензоата пиперидина в. 1 н. iNa2S04. [9] |
В первом случае независимо от того, какой реакцией определяется скорость коррозии, коррозионный ток в системе возрастает и скорость процесса будет выше, чем в неингибированном электролите. Во втором случае увеличение скорости коррозии, вызванное изменением эффективности катодного процесса, будет несколько ослаблено замедлением анодной реакции и, в принципе, эти два противоположно действующих фактора могут друг друга уравновесить настолько, что скорость коррозии не изменится. [10]
Стационарный потенциал магния примерно на один вольт оказывается положительное его нормального потенциала. В нейтральных или слабощелочных электролитах сдвиг потенциала магниевого электрода в область более положительных значений зависит от наличия на его поверхности сплошной пленки, способствующей замедлению анодной реакции. Поэтому потенциал магниевого анода в водных электролитах зависит прежде всего от солевого состава и в меньшей степени от концентрации собственных ионов, которые и определяют стационарный потенциал магниевого электрода. Вещества, способствующие снятию окисной пленки или увеличивающие ее проницаемость, как правило, облегчают течение анодной реакции и сдвигают потенциал в область более отрицательных значений. Наоборот, вещества, создающие защитную пленку, тормозят анодную реакцию и сдвигают потенциал магниевого электрода в область более положительных значений. Первый случай наблюдается при наличии в среде ионов хлора СПи серной кислоты S0 - -, способных легко проникать через пленку; второй случай - в щелочных средах или в присутствии ионов, образующих нерастворимые соединения магния. [11]
Изучая поляризационные явления в воде и серной кислоте с добавками аминов, Хаккерман и Сэдбери [106] нашли, что эти ингибиторы могут влиять как на катодные, так и на анодные участки поверхности. Анодное ингибирующее действие объясняется тем, что миграция электронов происходит скорее от металла к положительно заряженному ингибитору, чем к катодным участкам поверхности. Необходимо, однако, отметить, что органические соединения, в основном, считаются катодными ингибиторами, а замедление анодной реакции является лишь дополнительным, но не главным фактором. [12]
Как видно из рисунка, борат натрия при небольших содержаниях увеличивает скорость коррозии. Пройдя через максимум, скорость коррозии падает, и при концентрации NaBO3 0 314 моль / л коррозия стали полностью прекращается. Это происходит потому, что при больших добавках ингибитора, начиная с 0 1 моль / л, наступает замедление анодной реакции и скорость коррозии уменьшается. [13]
Как видно из рисунка, борат натрия при небольших содержаниях увеличивает скорость коррозии. Пройдя через максимум, скорость коррозии падает, и при концентрации NaBO3 0 314 моль / л коррозия стали полностью прекращается. Это происходит потому, что при больших добавках ингибитора, начиная с 0 1 моль / л, наступает замедление анодной реакции и скорость коррозии уменьшается. В качестве ингибиторов применяют в основном вольфрамат, молибдат, ванадат и ортова-надат натрия. [14]
Потенциалы никелированных образцов ( рис. 47, б), как и медненых, располагаются между потенциалами подложки и покрытия. Однако, в отличие от меди, при увеличении толщины никелевого покрытия до 50 мкм не удается полностью исключить электрохимическое влияние основы и получить совпадение потенциала электрода и потенциала никеля. При малых толщинах никелевого покрытия ( 1 5 и 10 мкм) потенциал разблагораживается, а при более толстых слоях облагораживается во времени, что указывает, соответственно на ускорение и замедление анодной реакции в порах. [15]
Страницы: 1 2