Потенциал - золото
Cтраница 1
Потенциал золота больше потенциалов хрома и железа, поэтому реакция протекает только в сторону выделения металлического золота. Золото растворяться не будет, выделение же хрома и железа невозможно. [1]
Снижение потенциала золота вследствие комплексообразования обусловливает протекание и других ранее упоминавшихся реакций растворения золота ( см. гл. [2]
Вследствие значительной разницы между потенциалами золота и металла - цементатора равновесие реакций ( 185) и ( 186) сильно сдвинуто вправо. [3]
Последнее уравнение показывает, что потенциал золота можно снизить, уменьшая активность ионов AU в растворе. Это обстоятельство и лежит в основе процесса растворения золота в цианистых растворах. [4]
Металлы-примеси, имея потенциалы более отрицательные, чем потенциалы золота и водорода, на катоде восстанавливаются в небольшой степени. [5]
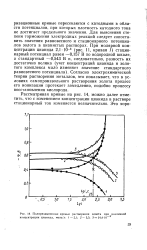 |
Поляризационные кривые растворения золота при различной концентрации цианида, моль / л. 1 - 2 1. 2 - 5 5. 3 - 14 4 - 10. [6] |
Для выяснения степени торможения электродных реакций следует сопоставить значения равновесного и стационарного потенциалов золота в цианистых растворах. Согласно электрохимической теории растворения металлов, это показывает, что в условиях самопроизвольного растворения золота процесс его ионизации протекает замедленно, подобно процессу восстановления кислорода. [7]
Золото во многих растворах имеет положительное значение потенциала, но в цианистых электролитах потенциал золота ( отрицательный) становится больше, чем у серебра. [8]
Близкое сходство реакций растворения золота в цианистых и тиосульфатных растворах, которое выражается в смещении потенциала золота в такую область, где возможно восстановление кислорода, позволяет сделать косвенное заключение и о сходстве механизмов сравниваемых реакций. А поскольку для реакции цианирования механизм изучен подробно, можно считать это подтверждением термодинамического обоснования возможности растворения золота в тиосульфатных растворах. [9]
Подвергаемое рафинированию золото содержит часто значительное количество серебра [ до 20 % ( масс.) ], платиноиды [ до 50 % ( масс.) ], медь, свинец и некоторые другие примеси. Электродные потенциалы примесей более отрицательны, чем потенциал золота. [10]
Уравнение (10.5) позволяет определить возможность протекания коррозии различных металлов. Если потенциал металла положительное потенциала кислородного электрода ( см. рис. 9.6, область 3), то коррозия металла невозможна. Потенциал золота, например, в отсутствие лигандов во всей области рН положительное потенциала кислородного электрода, поэтому золото с поглощением С2 и выделением Н2 корродировать не может. Если потенциал металла положительное потенциала водородного электрода и отрицательнее потенциала кислородного электрода ( см. рис. 9.6, область 2 то коррозия возможна с поглощением кислорода и невозможна с выделением водорода. [11]
Если потенциал металла положительнее потенциала кислородного электрода ( область 3), то коррозия металла невозможна. Потенциал золота, например, в отсутствие комплексо-образователя во всей области рН положительнее потенциала кислородного электрода, поэтому золото с поглощением О2 и выделением Н2 корродировать не может. Если потенциал металла положительнее потенциала водородного электрода и отрицательнее потенциала кислородного электрода ( область 2), то коррозия возможна с поглощением кислорода и невозможна с выделением водорода. Наконец, если потенциал металла ( область 1) отрицательнее потенциала водородного электрода, то возможна коррозия как с поглощением кислорода, так и с выделением водорода. [12]
Если потенциал металла положи-тельнее потенциала кислородного электрода ( область 3), то коррозия металла невозможна. Потенциал золота, например, в отсутствие комплексообразователя во всей области рН положи-тельнее потенциала кислородного электрода, поэтому золото с поглощением СЬ и выделением ЬЬ корродировать не может. Если потенциал металла положительнее потенциала водородного электрода и отрицательнее потенциала кислородного электрода ( область 2), то коррозия возможна с поглощением кислорода и невозможна с выделением водорода. Наконец, если потенциал металла ( область /) отрицательнее потенциала водородного электрода, то возможна коррозия как с поглощением кислорода, так и с выделением водорода. [13]
 |
Потенциалы сплавов Си - Zn в зависимости от содержания компонентов ( система с химическими соединениями. Раствоо 1-я. ZnSO4, 1-я. H2SO4. [14] |
Как видно из приведенного рисунка ( потенциал меди находится в исходной точке координат), потенциал сплава почти линейно сдвигается к более электроположительным значениям по мере увеличения концентрации золота. Аи сплав практически принимает потенциал золота. То же самое наблюдается и с твердыми растворами N1 - Си с содержанием окшго 7 6 - 13 / о ( ат. Си: потенциал сплава принимает значение потенциала Си. Это происходит от того, что атомы электроположительного компонента, находящиеся в достаточной доле в кристаллической решетке, начинают экранировать атомы более электроотрицательного. [15]
Страницы: 1