Потенциал - ионизация - электрон
Cтраница 1
 |
Оценка энергий С-С - и С - Н - связей в цикло-алканах по данным их потенциалов ионизации. [1] |
Потенциал ионизации электронов с ВЗМО циклопропана равен потенциалу ионизации Tt-электронов с ВЗМО этилена ( см. разд. [2]
Так, оказывается, что потенциалы ионизации электронов ( повидимому, необобщенных электронов) атомов галоида в галоидных алкилах оказываются по крайней мере на 1 вольт ниже, чем у галоидоводородов. [3]
Из табл. 4 видно, что потенциалы ионизации электронов с внешнего квантового уровня резко отличаются от потенциалов ионизации электронов с предыдущего квантового уровня. [4]
Здесь а - кулоновский интеграл, достаточно хорошей оценкой которого является потенциал ионизации электрона, находящегося на АО изолированного атома. [5]
Здесь ац - кулоновский интеграл, достаточно хорошей оценкой которого является потенциал ионизации электрона, находящегося на АО изолированного атома. [6]
Здесь а - кулоновский интеграл, достаточно хорошей оценкой которого является потенциал ионизации электрона, находящегося на АО изолированного атома. [7]
В тетрафторэтилене существует возможность стабилизации иона за счет сопряжения, а следовательно, возможность снижения потенциала ионизации электронов двойной связи. В самом деле для этилена27 потенциал ионизации составляет 10 51 эк, а для тетрафторэтилена5 - 10 12 эв. Следует ожидать, что величина указанного эффекта, обусловленного такими стабилизирующими ион структурами, как СХ2 СХ-F, будет порядка 1 эв на атом фтора. Этот эффект противоположен индукционному влиянию атомов фтора в основном состоянии, обусловливающему повышение степени связывания электронов и увели чение ионизационного потенциала. [8]
Взятое со знаком минус значение энергии, полученное при решении векового уравнения, можно приравнивать потенциалу ионизации электрона этой МО в предположении, что волновые функции остальных электронов при ионизации молекулы не изменяются ( см. разд. В нашем расчете потенциал ионизации молекулы LiH получается равным 10 8 эв. Самосогласованные вычисления Каро и Олсена дают 8 3 эв, что довольно хорошо согласуется с экспериментальным значением 8 эв. [9]
Из табл. 4 видно, что потенциалы ионизации электронов с внешнего квантового уровня резко отличаются от потенциалов ионизации электронов с предыдущего квантового уровня. [10]
В тетрафторэтилене существует возможность стабилизации иона за счет - сопряжения, а следовательно, возможность снижения потенциала ионизации электронов двойной связи. В самом деле для этилена27 потенциал ионизации составляет 10 51 эв, а для тетрафторэтилена5 - 10 12 эв. Следует ожидать, что величина указанного эффекта, обусловленного такими стабилизирующими иоя - структурами, как СХ2 СХ - F, будет порядка 1 эв на атом фтора. Этот эффект противоположен индукционном влиянию атомов фтора в основном состоянии, обусловливающему - повышение степени связывания электронов и увеличение ионизационного потенциала. [11]
 |
Спектр, указывающий на преддиссоциацню [ Kicks 1. М.. Barrow К. F., Caitad. J. Phys., 47, 2423 ( 1969, with permission ]. t. [12] |
Сильносвязанные электроны имеют высокие потенциалы ионизации, а слабосвязанные электроны - низкие. Определив потенциалы ионизации электронов на различных орбиталях, можно получить картину орбитальных энергий. [13]
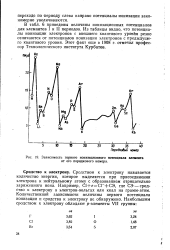 |
Зависимость первого ионизационного потенциала элемента от его порядкового номера. [14] |
В табл. 6 приведены величины ионизационных потенциалов для элементов I и II периодов. Из таблицы видно, что потенциалы ионизации электронов с внешнего квантового уровня резко отличаются от потенциалов ионизации электронов с предыдущего квантового уровня. [15]
Страницы: 1 2