Потенциал - ртутный катод
Cтраница 1
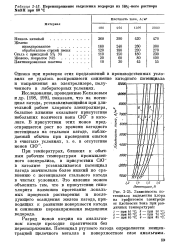 |
Перенапряжение выделения водорода из 16 % - ного раствора NaOH при 80 С.| Зависимость потенциала выделения хлора на графитовом электроде от плотности тока при различных температурах. [1] |
Потенциал ртутного катода определяется концентрацией щелочного металла в поверхностном слое амальгамы. [2]
Потенциал ртутного катода незначительно возрастает с повышением концентрации натрия в амальгаме и увеличением плотности тока. [3]
Потенциал ртутного катода в тот момент, когда достигнута величина напряжения разложения и начинается электролиз, называется потенциалом выделения ( или восстановления) данного иона. Потенциал выделения зависит от природы иона, однако на эту величину оказывает влияние концентрация восстанавливающегося иона и некоторые другие факторы. Поэтому для качественного определения ионов пользуются так называемым потенциалом полуволны, который не зависит от концентрации восстанавливающегося иона. [4]
Потенциал ртутного катода в тот момент, когда достигнута величина напряжения разложения и начинается электролиз, называется потенциалом выделения ( или восстановления) данного иона. Потенциал выделения зависит от природы иона, однако на эту величину оказывает влияние концентрация восстанавливающегося иона и некоторые другие факторы. Потенциал полуволны не зависит от концентрации восстанавливающегося иона. [5]
 |
Компенсационная схема для измерения потенциалов отдельных электродов. [6] |
При измерении потенциала ртутного катода необходимо следить, чтобы конец ключа не погружался в ртуть и не удалялся от поверхности ртути на заметное расстояние: если ключ несколько удален от поверхности электрода, то в измеренную величину войдет не только потенциал электрода, но и падение напряжения в электролите на участке между измеряемым электродом и отверстием электролитического ключа. [7]
Получено уравнение для расчета потенциалов поляризованного ртутного катода, текущего по несмачиваемой амальгамой основе, при электролизе раствора хлористого натрия. Дается оценка влияния основы на содержание водорода в хлоргазе хлорного электролизера. [8]
Получено уравнение для расчета потенциалов поляризованного ртутного катода, текущего по несмачивае-ной амальгамой основе, при электролизе раствора хлористого натрия. Дается оценка влияния основы на содержание водорода в ххоргазе хлорного электролизера. [9]
Подучено уравнение для расчета потенциалов поляризованного ртутного катода, текущего по несмачивае-ной амальгамой основе, при электролизе раствора хлористого натрия. Дается оценка влияния основы на содержание водорода в хлоргазе хлорного электролизера. [10]
Получено уравнение для расчета потенциалов поляризованного ртутного катода, текущего по несмачивае-иой амальгамой основе, при электролизе раствора хлористого натрия. Дается оценка влияния основы на содержание водорода в хлоргазе хлорного электролизера. [11]
Подучено уравнение для расчета потенциалов поляризованного ртутного катода, текущего по несмачиваемой амальгамой основе, при электролизе раствора хлористого натрия. Дается оценка влияния основы на содержание водорода в хлоргазе хлорного электролизера. [12]
Таким образом, метод полярографии сводится к снятию зависимости потенциала ртутного катода от силы внешнего тока. [13]
Проведенные эксперименты показывают, что в области, где наблюдается существенное смещение потенциала ртутного катода, восстановление ацетона протекает достаточно интенсивно. В растворе такой же концентрации на фоне хлористого лития ацетон восстанавливается с невысоким выходом по току. В разбавленных растворах ацетона пинакона практически не образуется. При переходе к растворам, содержащим более чем 1 0 N концентрацию ацетона, последний восстанавливается на фоне хлористого лития с высоким выходом, причем продуктами восстановления являются как пинакон, так и изопро-лиловый спирт, выход пинакона по веществу составляет около 15 % от прореагировавшего ацетона. В кислых растворах значительная доля тока расходуется на образование диизопропилртути. [14]
Для определения кадмия, присутствующего в растворе наряду с таллием, используют ртутный катод и платиновый анод. Потенциал ртутного катода должен обеспечивать разряд только ионов кадмия. Окончание выделения кадмия определяют по падению силы тока до постоянной величины. Количество протекшего электричества находят по кулонометру, включенному последовательно с электролизером, а затем, зная электрохимический эквивалент кадмия, вычисляют его содержание в растворе. Если в том же растворе необходимо определить также и таллий, то, сместив потенциал ртутного катода до требуемой величины, проводят анализ так, как это было только что описано для кадмия. [15]
Страницы: 1 2 3