Потенциал - коррозия - сплав
Cтраница 1
Потенциалы коррозии сплава Ti - 2 % Ni в активном состоящий ( - 0 35 - - 0 27 В) во всех растворах на 0 15 - 0 17 В положи-тельнее потенциалов коррозии титана ВТ1 - 0 ( - 0 45 - г - 0 47В), что, вероятно, вызвано облегчением катодных процессов на сплаве, которое и является, в частности, одной из причин более высокой скорости коррозии сплава Ti - 2 % Ni в активном состоянии. [1]
Поэтому значение потенциала коррозии сплава в сравнении с потенциалами коррозии чистых компонентов может указывать на возможность появления фазовых превращений. [2]
Фаза 7, электрохимически наименее устойчивая при потенциале коррозии сплава ВАД23, выделяется преимущественно не по границам зерен, вызывая питтинговую коррозию полуфабрикатов из этого сплава. По этой причине сопротивление общей коррозии понижается. [3]
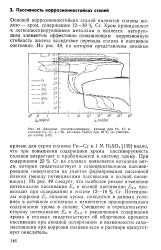 |
Анодные поляризационные кривые для Fe, Cr и сплавов Fe-Сг в 1 М. растворе HaSC при 25 С ( в атмосфере азота. [4] |
Сг в 1 М H2SO4 [139] видно, что при повышении содержания хрома пассивируемость сплавов возрастает и приближается к чистому хрому. Потенциалы коррозии Ек сплавов хрома, находятся в данных условиях в активном состоянии и изменяются пропорционально содержанию хрома в сплаве. [5]
На анодной кривой 2 нелегированното тантала ( рис. 18), напротив, отсутствует область, где он активно растворяется. При легировании ванадия танталом потенциал коррозии сплавов смещается в положительную сторону. Анодные кривые сплавов располагаются между кривыми нелегированных металлов. При этом в зависимости от содержания тантала в сплаве меняется характер кривых. Для сплавов с 50 % тантала и выше на анодных кривых отчетливо проявляется область независимости плотности тока от потенциала. [7]
Легирование всеми перечисленными элементами в небольших количествах облегчает самопроизвольный переход сплава в пассивное состояние. С увеличением содержания легирующих компонентов потенциал коррозии сплавов сдвигается в положительную область. Использование таким образом легированного титана расширяет возможность его применения как конструкционного металла в более агрессивных средах. [8]
Во времени, вследствие затруднения доступа окислителя и расходования его в коррозионном процессе, снижается его концентрация в щели, и эффективность катодного процесса уменьшается. Если при уменьшении концентрации окислителя катодный ток обеспечивает поддержание пассивного состояния и потенциал коррозии сплава остается в пассивной области, то коррозионный ток практически не меняется. При дальнейшем уменьшении концентрации величина катодного тока становится настолько малой, что потенциал металла смещается в отрицательную сторону, металл в щели переходит в активное состояние и скорость его растворения увеличивается. Появление в растворе продуктов коррозии и их гидролиз приводят к подкислению раствора. Протекание коррозионного процесса при ограниченной скорости подвода свежего электролита вызывает дальнейшее понижение рН, что облегчает анодный процесс растворения металла и создает возможность протекания катодного процеса с водородной деполяризацией. Это увеличивает коррозионный ток. Процесс под-кисления коррозии в щели особенно ускоряется, если металл в щели при смещении потенциала в отрицательную сторону становится анодом по отношению к металлу открытой поверхности, что обычно наблюдается в практических случаях щелевой коррозии. [9]
Торможение анодных процессов при коррозии осуществляется за счет изменения состава юплава, коррозионной среды или условий протекания коррозионного процесса, как это рассмотрено в гл. Ниже будет рассмотрено торможение анодного процесса только за счет изменения состава металлического сплава. Следует разграничивать, по крайней iMape, три возможных направления: 1) уменьшение площади анодных участков; 2) легирование, непосредственно повышающее анодную пассивируемость; 3) легирование, повышающее катодную эффективность и смещающее потенциал коррозии сплава в пассивную область. [10]
Эффективное снижение скорости коррозии никеля наблюдается при введении в сплав 27 - 28 % Мо. Молибден, имеющий высокую коррозионную стойкость в неокислительных средах и низкую в окислительных условиях вследствие перепассивации, оказывает аналогичное действие и на сплавы с никелем. Сплав Н70М27Ф коррозионностоек в НС1 всех концентраций до температуры 70 С и до 10 % - ной концентрации при кипении ( скорость коррозии К менее 0 2 мм / год), в кипящей 15 - 21 % - ной НС1 К не превышает 0 5 мм / год. В присутствии же Б растворе соляной кислоты окислителей: кислорода, хлорного железа, хлора, когда потенциал коррозии сплава смещается в положительную сторону, коррозионная стойкость никельмолибденового сплава сильно снижается. [11]
Алюминий и его сплавы исключительно чувствительны к анодной поляризации вследствие явления анодной пассивности. При сдвиге потенциала сплава выше определенного критического значения наступает пробой пленки в отдельных точках. В месте пробоя пленки идет интенсивное растворение металла с образованием коррозионной точки. Поверхность алюминиевых сплавов с повышенным содержанием меди ( Д16, АК8) в электрохимическом отношении даже после закалки изделий в холодной воде неоднородна. Потенциалы участков с пониженным содержанием меди будут более отрицательными по сравнению с остальной поверхностью сплава. На этих участках за счет анодной поляризации наступает пробой окисной пленки и возникают коррозионные точки. Потенциал коррозии сплава системы Al-Zn-Mg имеет меньшее значение, чем критический потенциал образования коррозионной точки, поэтому в обычных условиях эти сплавы не подвержены точечной коррозии. Однако коррозия сплава 52 в контакте с катодным металлом ( сталь 45), как будет показано ниже, может иметь сильно выраженный точечный характер. При анодной поляризации вследствие контакта с катодным металлом электродный потенциал смещается в область пробоя быстрее. [12]
Страницы: 1
