Потенциал - максимум - ток
Cтраница 1
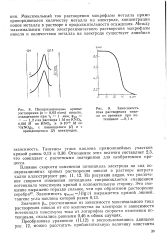
Потенциал максимума тока является функцией кинетических параметров процесса ( ks и р) и скорости изменения потенциала электрода. [1]
Потенциал максимума тока электрохимического растворения иодида ртути, как видно из рис. 52, линейно зависит от скорости изменения потенциала электрода. [2]
Положение кривой относительно оси потенциалов, характер зависимости потенциала максимума тока на кривой от скорости изменения потенциала, наклон прямолинейных участков кривых в координатах гмакс - Q, величина разности потенциалов в точках перегибов восходящей и нисходящей ветвей кривой позволяют определить кинетические параметры процесса. [3]
Значения 3, рассчитанные из зависимости максимального тока растворения никеля от его количества на электроде и зависимости потенциала максимума тока от логарифма скорости изменения потенциала, оказались равными 0 46 в обоих случаях. [5]
С учетом коэффициента шероховатости поверхности ( из емкостных данных) было вычислено, что количество окисла становится равным монослою лишь при потенциале ф - 0 35 в, который на 0 24 в положительнее потенциала максимума тока. Следовательно, начало пассивации в данном случае может быть связано с адсорбцией кислорода в количествах, значительно меньших монослоя. [6]
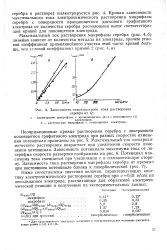 |
Зависимость максимального тока растворения серебра от Q. [7] |
Максимальный ток электрохимического растворения возрастает при увеличении скорости изменения потенциала. Потенциал максимума тока смещается при увеличении v в положительную сторону. [8]
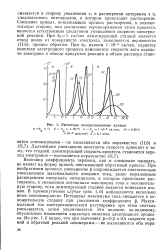 |
Расчетные поляризационные кривые. а - 1. б - & ЫО-5. в - k 1 - iO - 8 см / сек. с X 10 - моль / см3. v 0 1 в / сек. [9] |
Величина коэффициента переноса, как и следовало ожидать, не влияет на форму кривой, описывающей обратимый процесс. При необратимом процессе уменьшение В сопровождается значительным уменьшением максимального анодного тока, резко выраженным расширением интервала потенциалов, в котором происходит растворение, и смещением потенциала максимума тока в положительную сторону, если лимитирующей стадией является ионизация атомов. В промежуточном случае ( рис. 1 6) наблюдаются несколько иные закономерности. Максимальный ток электрохимического растворения при этом сначала уменьшается, затем увеличивается. Это явление, по-видимому, обусловлено изменением характера кинетики электродного процесса. [10]
При потенциалах положительнее точки В становится заметным торможение процесса, связанное с началом пассивации металла. Пассивация обусловлена образованием защитного слоя, который при дальнейшем повышении потенциала ( участок СЯ, так называемая переходная область, падающий участок), вероятно, продолжает распространяться по поверхности электрода. Потенциал максимума тока, который для достаточного развития пассивации должен быть обязательно превышен, часто называют критическим потенциалом пассивации ( фкр), а соответствующую плотность тока ( IKD) - критическим током пассивации. Область Я /, НК или ЯМ, где стационарная скорость растворения невелика ( 10 - 8 - 10 - 5 а / смг) и практически не зависит от потенциала и полностью связана с электрохимическим процессом ( суммарная реакция Me Mem - j - me), называют областью пассивного состояния, или, короче, пассивной областью. Рост скорости ионизации при увеличении потенциала здесь полностью компенсируется одновременно протекающим процессом увеличения количества пассивирующего вещества на поверхности и, возможно, повышением защитных свойств пассивирующего слоя. [11]
При необратимом процессе это отношение равно 1, поскольку скорость реакции разряда мала и величина концентрации ионов металла в приэлектрод-ном пространстве не входит в уравнение для тока. Поэтому перемешивание раствора или вращение электрода не влияет на поляризационные кривые. Максимальный ток при необратимом процессе ниже, чем при обратимом, когда потенциал максимума тока сравнительно мало смещается при изменении скорости развертки. Величина смещения зависит от гидродинамических условий. [12]
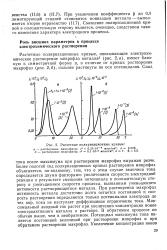 |
Расчетные поляризационные кривые. [13] |
Более пологий ход поляризационных кривых растворения микрофаз объясняется, по-видимому, тем, что в этом случае величина тока определяется двумя факторами: увеличением скорости электродной реакции в результате смещения потенциала в положительную сторону и уменьшением скорости процесса, вызванным уменьшением активности растворяющегося металла. При растворении макрофаз активность металла достаточно долго остается постоянной и скорость растворения определяется только потенциалом электрода до тех пор, пока не наступает диффузионное ограничение тока. Максимальный анодный ток растет при увеличении концентрации ионов электроактивного металла в растворе. В обратимом процессе он обычно выше, чем в необратимом. Потенциал максимума тока является постоянной величиной при растворении микрофаз и при обратимом растворении макрофаз. [14]
В процессе растворения металла на его поверхности одновременно протекают две электродные реакции: анодное растворение металла и катодное восстановление окислителя. Из условия стационарности следует, что для замедления скорости растворения металла достаточно снизить скорость хотя бы одной из электродных реакций. На рис. 5.1 приведена обобщенная потенциостатическая анодная поляризационная кривая. Область АВ называется областью активного растворения. Вначале скорость растворения металла экспоненциально увеличивается с увеличением потенциала по уравнению Тафеля. В переходной области ВС происходит пассивация металла, приводящая к резкому замедлению коррозии. Потенциал максимума тока называется критическим потенциалом пассивации Екр, а соответствующая ему величина / а - критической плотностью тока пассивации / кр. Область CD, характеризующаяся малыми скоростями коррозии ( обычно 10 - 8ч - 10-в А / см2), практически независимыми от потенциала, называется областью устойчивого пассивного состояния или пассивной областью. [15]
Страницы: 1 2